
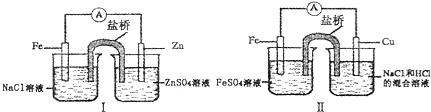
| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
分析 图中装置Ⅰ、Ⅱ都是原电池装置,装置Ⅰ中,Zn为负极,发生氧化反应Zn-2e-═Zn2+,Fe为正极,发生还原反应O2+2H2O+4e-═4OH-.装置Ⅱ中,Fe为负极,发生氧化反应Fe-2e-═Fe2+,Cu为正极,发生还原反应2H++2e-═H2↑,原电池工作时,阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.图中装置Ⅰ、Ⅱ都是原电池,装置Ⅰ中,Zn为负极,发生氧化反应Zn-2e-═Zn2+,装置Ⅱ中,Fe为负极,发生氧化反应Fe-2e-═Fe2+,故A错误;
B.装置Ⅰ中,Fe为正极,发生还原反应O2+2H2O+4e-═4OH-,装置Ⅱ中,Cu为正极,发生还原反应2H++2e-═H2↑,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,装置Ⅰ中,Zn为负极,Fe为正极,盐桥中的阳离子向左烧杯移动,装置Ⅱ中,Fe为负极,Cu为正极,盐桥中的阳离子向右侧烧杯移动,故C错误;
D.根据分析,图中装置Ⅰ、Ⅱ正极金属均未反应,被保护,故D正确;
故选D.
点评 本题考查原电池的工作原理,题目难度中等,注意电极的判断和电极方程式的书写,把握原电池的工作原理,装置Ⅰ借助吸氧腐蚀理解,学习中注意相关知识的把握.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g甲烷中含C-H键的数目为4NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA | |
| D. | 标准状况下,16g甲烷分子所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2 O | |
| C. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 纯碱溶液中通入二氧化碳:CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{60}×22.4$L | B. | $\frac{W}{100}×22.4$L | C. | $\frac{W-a}{40}×22.4$L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com