
| 元素 | A | B | C | D |
| 有关性质或结果信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上电子数的2倍 | 该元素形成的单质通常有两种同位素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原子分子 |
| 9.15g |
| 183g/mol |
| 1mol |
| 0.05mol |


科目:高中化学 来源: 题型:
| A、SO2、O2、HBr |
| B、H2、CH4、O2 |
| C、NH3、CO2、HCl |
| D、NH3、O2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
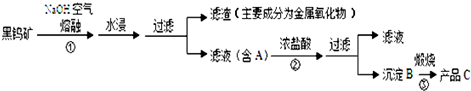
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 除一种元素外,其余由元素周期表中前20号元素组成的物质A、B、C、D、E,它们间的反应关系如图:
除一种元素外,其余由元素周期表中前20号元素组成的物质A、B、C、D、E,它们间的反应关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
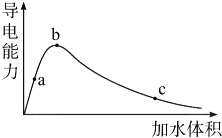 Ⅰ.醋酸是我们很熟悉的一种有机物.
Ⅰ.醋酸是我们很熟悉的一种有机物. | c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com