
分析 碳酸钡饱和溶液中存在BaCO3(s)?Ba2+(aq )+CO32-(aq),c(CO32-)可影响平衡的移动,c(CO32-)越小,Ba2+的浓度越大,根据选项中的物质中的离子对碳酸钡的溶解是促进还是抑制来分析Ba2+的浓度.
解答 解:①BaCO3加入30mL水中,充分溶解至溶液饱和存在:BaCO3(s)?Ba2+(aq )+CO32-(aq),则溶液中存在一定浓度的Ba2+,但浓度较小;
②将足量BaCO3加入10mL 0.2mol/L Na2CO3溶液中,由于碳酸根离子的浓度较大,抑制碳酸钡的溶解,则Ba2+的浓度很小;
③将足量BaCO3加入50mL 0.01mol/L氯化钡溶液中,氯化钡电离产生0.01mol/LBa2+,则Ba2+的浓度较大;
④将足量BaCO3加入100mL0.01mol/L盐酸中,碳酸钡与盐酸反应生成0.005mol/LBa2+,则Ba2+的浓度较大;
所以Ba2+的浓度由大到小的顺序为:③>④>①>②,
故答案为:③④①②.
点评 本题考查了溶液中离子浓度大小比较,为高频考点,侧重于平衡移动原理的应用的考查,注意把握难容电解质的溶解平衡的移动,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.1molKClO2 | D. | 0.2molKClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
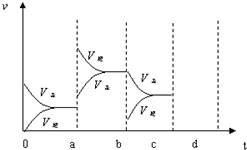 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com