
| 4x+8y |
| x+y |
| 6x+8y |
| x+y |
| 7 |
| 4 |
| 1×1+4×3 |
| 4 |
| 2×1+4×1 |
| 2 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、③⑥⑦⑨ | B、③⑤⑦⑨ |
| C、①④⑧⑩ | D、②⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
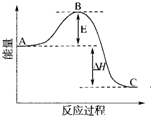 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
 根据表中信息回答下列问题.
根据表中信息回答下列问题.| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 |
高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI═Se↓+2I2+3H2O |
| 2 | ||
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
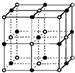 用序号填空:
用序号填空:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
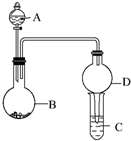 用如图所示装置进行实验(夹持装置已略去).请回答下列问题:
用如图所示装置进行实验(夹持装置已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有1mol NH3分子 |
| B、含NH3和NH4+之和为1mol |
| C、含NH3?H2O 1mol |
| D、含NH3、NH3?H2O、NH4+之和为1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com