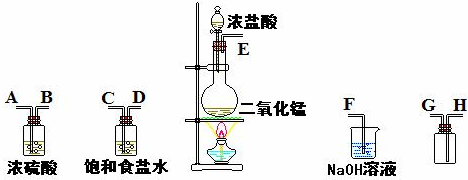
解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl
2+H
2O=H
++Cl
-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收氯气生成氯化钠、次氯酸钠和水,防止污染空气;
故答案为:除去挥发出的HCl气体,抑制C1
2在水中的溶解;吸收多余的Cl
2;
(3)实验中常用湿润的淀粉-KI试纸检验是否有Cl
2产生.如果有Cl
2产生,氯气和碘化钾反应:2KI+Cl
2═2KCl+I
2;生成的单质碘,碘遇淀粉变蓝,所以试纸变蓝,发生的反应化学方程式为:2KI+Cl
2═2KCl+I
2;将试纸长时间放在产生Cl
2的导管口,在看到以上现象后,发现试纸又变为无色,是因为氯气氧化碘单质为碘酸钾,变为无色;
故答案为:试纸变蓝;2KI+Cl
2═2KCl+I
2;过量的Cl
2把I
2氧化为更高价态的碘的化合物;
(4)①气体发生装置中进行的反应是氯气的实验室制备反应,反应的化学方程式为:MnO
2+4HCl(浓)

MnCl
2+Cl
2+2H
2O;故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2+2H
2O
②NaOH溶液中发生的反应是氢氧化钠溶液吸收氯气防止污染,反应的化学方程式为:2NaOH+Cl
2═NaCl+NaClO+H
2O;故答案为:2NaOH+Cl
2═NaCl+NaClO+H
2O;
分析:(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)根据氯气、氯化氢的性质分析;根据氢氧化钠溶液的性质分析作用;
(3)根据氯气的氧化性,碘离子的还原性分析氯气和碘化钾反应生成单质碘和氯化钠,碘单质遇淀粉变蓝;将试纸长时间放在产生Cl
2的导管口,在看到以上现象后,发现试纸又变为无色氯气氧化碘单质为高价态点的化合物;
(4)依据实验制备氯气气体所用原料为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;氯气有毒不能排放到空气中 污染环境用氢氧化钠溶液吸收;
点评:本题考查了实验装置仪器的连接顺序是实验发生装置→除杂装置→收集装置→尾气处理装置;实验室制备气体的装置选择,实验除杂的方法选择和试剂作用,化学方程式的书写方法,现象判断,题目难度中等.

 MnCl2+Cl2+2H2O;故答案为:MnO2+4HCl(浓)
MnCl2+Cl2+2H2O;故答案为:MnO2+4HCl(浓) MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O

 阅读快车系列答案
阅读快车系列答案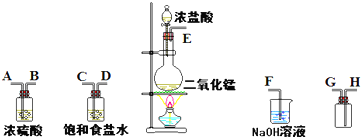


 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
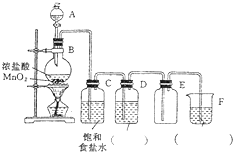 在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图:
在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图: