
| 1.0mol |
| 0.2mol |
| 2.0mol |
| 0.2mol |
| 催化剂 |
| △ |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
| A、abXn-含有的中子数为a+b | ||
B、X原子的质量约为
| ||
| C、X原子的质量数为a+b+n | ||
| D、abXn-含有的电子数为a-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
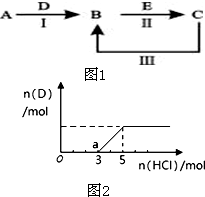 A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如图1所示:
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
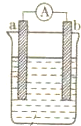 如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:
如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠、液态氧、碘酒 |
| B、生石灰、白磷、熟石灰 |
| C、干冰、铁、氢氧化铁胶体 |
| D、空气、氮气、胆矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com