
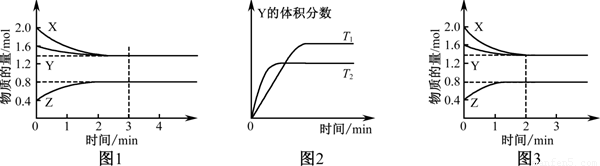
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。则下列结论正确的是( )

A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强
B
【解析】
试题分析:A、关键图(1)可知,反应进行的前3min内,v(X)=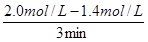 =0.2mol/(L•min),故A错误;B、根据图(1)分析,反应中X、Y的物质的量浓度逐渐减小,Z的物质的量浓度逐渐增大,所以X、Y为反应物,Z为生成物,根据浓度的变化量与化学计量数成正比可知0.6:0.2:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g)
=0.2mol/(L•min),故A错误;B、根据图(1)分析,反应中X、Y的物质的量浓度逐渐减小,Z的物质的量浓度逐渐增大,所以X、Y为反应物,Z为生成物,根据浓度的变化量与化学计量数成正比可知0.6:0.2:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g) 2Z(g),故B正确;C、根据图(2)中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大,说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,则平衡常数增大,故C错误;D、图(3)与图(1)比较,图(3)到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变。由于正方应是体积减小的可逆反应,所以应是加入催化剂所致,故D错误,答案选B。
2Z(g),故B正确;C、根据图(2)中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大,说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,则平衡常数增大,故C错误;D、图(3)与图(1)比较,图(3)到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变。由于正方应是体积减小的可逆反应,所以应是加入催化剂所致,故D错误,答案选B。
考点:考查化学平衡移动以及平衡图象分析等
点评:该题是高考中的常见题型,试题综合性强,难易适中。注重对学生基础知识的巩固和训练,侧重对学生分析、归纳和总结问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。答题时注意分析图象中曲线的变化规律,结合外界条件对平衡移动的影响进行分析、判断即可。


科目:高中化学 来源:2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷(带解析) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | | | | |
| ③ | | 粗颗粒 | | |
| ④ | | | |
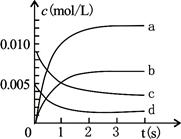
 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期“一诊”模拟理综化学试卷(解析版) 题型:选择题
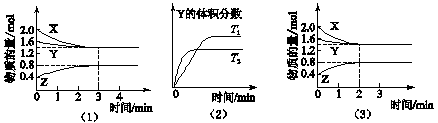
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
B.平衡时容器内的压强为反应前的0.9倍
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图 (1)所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图 (2)所示。则下列结论正确的是
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为:3X(g)+Y(g)![]()
![]() 2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图 (3)所示,则改变的条件是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com