
| A. | C2H4 | B. | CH4 | C. | CH3COOCH2CH3 | D. | C2H5OH |
科目:高中化学 来源: 题型:选择题
| A. | 新方法利用的是化学变化,旧方法利用的是物理变化 | |
| B. | 反应②中既有旧化学键的断裂又有新化学键的形成 | |
| C. | 在反应①中每生成 12g 金刚石需要消耗 46g 金属钠 | |
| D. | 反应①和反应②中所得的金刚石都是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
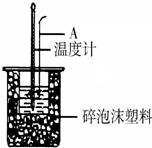 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下查看答案和解析>>
科目:高中化学 来源: 题型:解答题
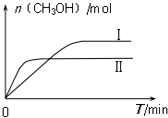 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
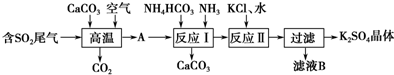
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 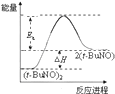 | B. | 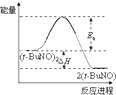 | C. | 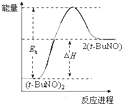 | D. | 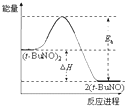 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol•L-1KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1 | |
| C. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com