
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液中:K+、Cu2+、NO![]() 、Cl-
、Cl-
B.0.1 mol·L-1CaCl2溶液中:Mg2+、NH![]() 、CO
、CO![]() 、SO
、SO![]()
C.pH=12的溶液:Na+、K+、SiO![]() 、Cl-
、Cl-
D.使甲基橙变红的溶液中:Na+、Fe2+、NO![]() 、Cl-
、Cl-
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300ml 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在,钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
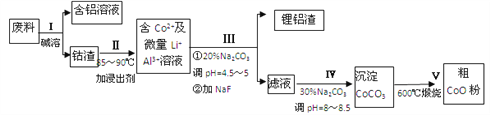
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为________
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________________
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用 盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因是____________________
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式__________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据给定信息书写氧化还原方程式:(9分)
(1)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。
(2)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。
(3)在盛有10mL1.0mol·L-1的碘水的试管中,通入足量Cl2完全反应后,共转移了0.1mol电子。写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向正反应方向移动的是
A、N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B、H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C、N2(g)+3H2(g)![]() 2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
D、2SO2(g)+O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如右图所示,请回答:

(1)a、c线分别代表溶液中__________、________(填离子符号,下同)的变化情况;
(2)原溶液中FeI2的物质的量为__________;
(3)原溶液中Fe2+与Br-的物质的量之比为____________;
(4)当通入2mol Cl2时,溶液中离子反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的
A. 质量 B. 密度 C. 碳原子数 D. 原子总数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com