
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
分析 A.NO在空气中与氧水反应形成酸雨,可破坏臭氧层;
B.NO中N元素的化合价为+2价,为低价氧化物,某些含高价N物质还原可生成NO,N元素的最低化合价为-3价,也可以是某些含低价N物质的氧化产物;
C.可以用排水法气体需难溶于水,向上排空气法收集气体需密度比空气大且不和空气的主要成分反应;
D.少量的一氧化氮有扩张血管,增加记忆的功能,NO为当今生物科学研究的热点.
解答 解:A.氮的氧化物,硫的氧化物是形成酸雨的主要原因,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成一氧化氮和硝酸形成酸雨,氮氧化物、氟利昂等都是破坏臭氧层的气体,所以NO也能破坏臭氧层,故A正确;
B.NO中N元素的化合价为+2价,为低价氧化物,可以是硝酸(N+5价)被还原的产物,如铜和稀硝酸反应:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可以是某些含低价N物质的氧化产物,如氨气(N-3价)的催化氧化反应:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故B正确;
C.NO难溶于水可以用排水法收集,NO密度与空气接近且一氧化氮易与空气中的氧气反应生成二氧化氮,不能用排空气法收集,故C错误;
D.近几年来,科学发现在生物体内存在少量一氧化氮,它有扩张血管和增强记忆力的功能,故D正确;
故选C.
点评 本题考查NO的性质,掌握一氧化氮的性质是解答关键,注意NO密度与空气接近且一氧化氮易与空气中的氧气反应生成二氧化氮是不能用排空气法收集的原因为高频考点和易错点,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
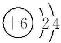 B.
B. C.
C.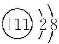 D.
D.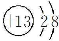
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 金属性:Na>Mg | D. | 水中溶解性:Mg(OH)2>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
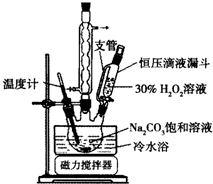 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
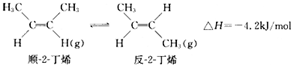
| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com