
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
分析 电解池中,要想使电解质溶液复原,遵循的原则是:电解后从溶液中减少的物质是什么就利用元素守恒来加什么.
解答 解:A、电解氯化铜时,阳极放氯气,阴极生成金属铜,所以应加氯化铜让电解质溶液复原,故A错误;
B、电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,故B正确;
C、电解氢氧化钠时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,故C错误;
D、电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜让电解质溶液复原,加入氢氧化铜会多加入水,故D错误.
故选B.
点评 本题考查了电解池原理,分析两个电极上产生的物质,本着“出什么加什么”的思想来让电解质复原,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
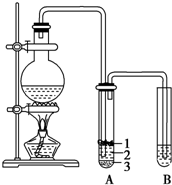 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-a-c)kJ | B. | (3a-b+c )kJ | C. | (a-3b+c)kJ | D. | (b-3a-c)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
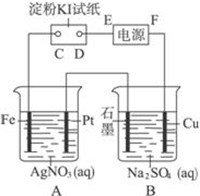 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com