
 2FeCl3 2FeCl3+Fe=3FeCl2
2FeCl3 2FeCl3+Fe=3FeCl2 2FeCl3 2FeCl3+Fe=3FeCl2
2FeCl3 2FeCl3+Fe=3FeCl2

科目:高中化学 来源:不详 题型:填空题
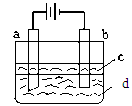
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
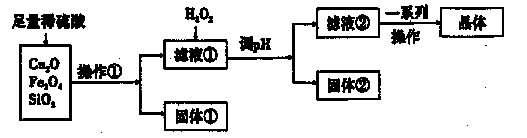
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属与盐溶液间的反应一定是置换反应 |
| B.能与酸反应的氧化物一定是碱性氧化物 |
| C.1 1H2和2 1H2的物理性质略有差异,化学性质几乎完全相同 |
| D.常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
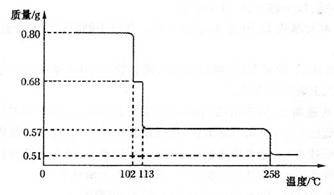
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com