

| A. | 步骤①③均发生了置换反应 | B. | 步骤③中SO2被还原 | ||
| C. | 步骤②③的目的是富集溴元素 | D. | 步骤④利用了溴易挥发的性质 |
分析 由分离流程可知,浓缩海水中溴离子的浓度较大,①中与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl,以此来解答.
解答 解:由分离流程可知,浓缩海水中溴离子的浓度较大,①中与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl,
A.③中发生Br2+2H2O+SO2═2HBr+H2SO4,生成物没有单质,不是置换反应,而步骤①发生了置换反应,故A错误;
B..③中发生Br2+2H2O+SO2═2HBr+H2SO4,S元素的化合价升高,失去电子,则SO2被氧化,故B错误;
C.利用步骤②③达到富集溴元素的目的,故C正确;
D.利用溴易挥发,向浓缩经氯气氧化后的海水中空气和水蒸气可吹出溴蒸气,步骤②利用了溴易挥发的性质,而④中发生Cl2+2HBr=Br2+2HCl,萃取、分液、蒸馏分离出溴,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中的反应、混合物分离方法为解答本题的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O(氧化物) | B. | H2SO4(含氧酸) | ||
| C. | CH3COOH(无机物) | D. | I2的CCl4溶液(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
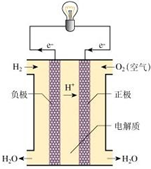
| A. | 通入 H2电极是负极 | |
| B. | 通入 O2电极发生氧化反应 | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由大到小的顺序为W>Z>Y>X | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | 与同浓度的盐酸反应,Z比W更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷不属于金属材料 | |
| B. | 钠钾合金的熔点介于钠和钾的熔点之间 | |
| C. | 纯铁比生铁的硬度大 | |
| D. | 铝在常温下不能与氧气反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com