
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
分析 A.离子核外电子层数越多,半径越大,核外电子排布相同的离子,核电荷数越大,离子半径越小;
B.结构相似,所带电荷相等时,离子半径越小,晶格能越大;
C.根据分子的构型判断;
D.原子半径越小,键长越短,则键能越大.
解答 解:A.离子核外电子层数越多,半径越大,O2-、F-、Na+核外电子排布相同,核电荷数越大,离子半径越小,则应为O2->F->Na+>Li+,故A错误;
B.四种物质所带电荷相同,由于离子半径:F-<Cl-<Br-<I-,因此晶格能:NaI<NaBr<NaCl<NaF,故B错误;
C.CH4为正四面体结构,H2O为V形结构,CO2为直线形结构,则分子中的键角:CH4<H2O<CO2,故C错误;
D.原子半径C-C<C-Si<Si-Si,原子半径越小,键长越短,则键能越大,故D正确.
故选D.
点评 本题考查较为综合,涉及离子半径、金属晶体的熔沸点、键角以及键能的大小比较,侧重于学生的分析能力和综合运用元素周期律知识的考查,难度不大,注意把握比较问题的角度和相关基础的积累.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+、OH-、Al3+、NO3- | B. | H+、CO32-、[Al(OH)4]-、Na+ | ||
| C. | [Al(OH)4]-、OH-、Na+、Cl- | D. | Ba2+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
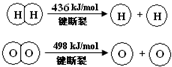
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1 mol H-O键需要的能量是463.4 kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8 kJ/mol | |
| D. | H2(g)中的H-H键能比H2O(g)中的H-O键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A的结构中含有碳碳双键 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有一种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | 根据图示可推知D为苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅由非金属元素不可能形成离子化合物 | |
| B. | 构成分子的粒子一定含有共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 凡是有化学键断裂过程一定发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com