
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
分析 (1)破坏1mol 物质中的化学键所消耗的能量越低则说明物质越不稳定,物质具有的能量越高;
(2)根据破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定;依据同主族元素非金属性越强,氢化物越稳定;
(3)形成新键释放的热量和旧键断裂吸收的热量多少判断;
(4)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,依据键能计算分析判断.
解答 解:(1)根据表中数据可知,破坏1molCl2中的化学键所消耗的能量为234KJ,破坏1molBr2中的化学键所消耗的能量为193KJ,破坏1molI2中的化学键所消耗的能量为151KJ,破坏1molH2中的化学键所消耗的能量为436KJ,所以破坏1molI2消耗能量最低,最不稳定,I2本身具有的能量最高;
故选:D;
(2)根据表中数据可知,破坏1mol氟化氢中的化学键所消耗的能量最高,则说明HF最稳定;若无上表中的数据,能正确回答出问题,因为F、Cl、Br、I为同主族元素,依据同主族元素性质递变规律可知,F、Cl、Br、I非金属性依次减弱,非金属性越强,与氢气化合越容易,反应放出热量越多,生成的氢化物越稳定;
故答案为:A;能;元素非金属性越强,形成的气态氢化物越稳定;
(3)根据反应X2+H2═2HX,可以计算新键生成释放的热量均大于旧键断裂吸收的热量,所以X2+H2═2HX的反应是放热反应,
故答案为:放热;
(4)根据表中数据可知,破坏1mol物质中的化学键所消耗的能量越高,生成物越稳定,发生该反应放出的热量越多,故答案为:氯气.
点评 本题考查了化学键与反应物稳定性的关系,明确键能大小与物质的稳定性关系是解题关键,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中H-半径比Li+半径小 | |
| C. | NaH跟液氨反应时,有NaNH2生成 | |
| D. | Na原子与H原子结合组成NaH过程中发生了电子转移. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有强酸和强碱是强电解质,只有弱酸和弱碱是弱电解质 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 易溶于水的强电解质水溶液中无溶质分子,易溶的弱电解质水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
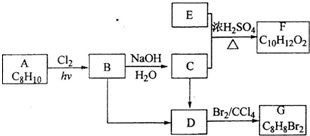
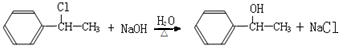 .
.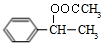 ;F与NaOH溶液共热发生反应的化学方程式为:
;F与NaOH溶液共热发生反应的化学方程式为: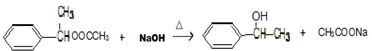 .
.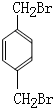 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
(1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 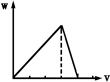 | B. | 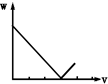 | C. | 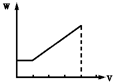 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | M与T形成的化合物熔沸点高 | |
| B. | 最高价氧化物对应的水化物碱性:L<Q | |
| C. | 氢化物的还原性:H2 R<H2 T | |
| D. | 离子半径:T2-<L2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com