
 ,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O
,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O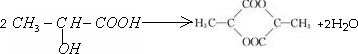 .
. ,F分子保水的原因-COONa 具有亲水性.
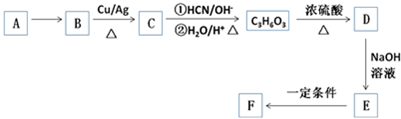
,F分子保水的原因-COONa 具有亲水性. 分析 A是石油裂解的主要产物之一,标准状况下,A相对于H2的密度是14,则A的相对分子质量为14×2=28,则A为CH2=CH2,C3H6O3为乳酸,C生成乳酸的转化发生信息给予的反应,则C为醛,B氧化得到C,则B为醇,故A与水发生加成反应生成B,B为CH3CH2OH,则C为CH3CHO,结合反应信息,乳酸的结构为CH3CH(OH)COOH,在浓硫酸、加热条件下发生消去反应生成D,D为CH2=CHCOOH,D与氢氧化钠反应生成E,E为CH2=CHCOONa,E发生加聚反应得到高聚物F,F为 ,据此解答.
,据此解答.
解答 解:A是石油裂解的主要产物之一,标准状况下,A相对于H2的密度是14,则A的相对分子质量为14×2=28,则A为CH2=CH2,C3H6O3为乳酸,C生成乳酸的转化发生信息给予的反应,则C为醛,B氧化得到C,则B为醇,故A与水发生加成反应生成B,B为CH3CH2OH,则C为CH3CHO,结合反应信息,乳酸的结构为CH3CH(OH)COOH,在浓硫酸、加热条件下发生消去反应生成D,D为CH2=CHCOOH,D与氢氧化钠反应生成E,E为CH2=CHCOONa,E发生加聚反应得到高聚物F,F为 ,
,
(1)B为CH3CH2OH,B中官能团的名称 羟基,C为CH3CHO,C中官能团为醛基,醛基的检验方法是取适量的C,加入新制氢氧化铜,加热,若有砖红色沉淀生成,则证明有醛基,
故答案为:羟基;取适量的C,加入新制氢氧化铜,加热,若有砖红色沉淀生成,则证明有醛基;
(2)根据上面的分析可知,乳酸分子的结构简式 CH3CH(OH)COOH,一定条件下,两分子乳酸反应生成一种六元环状化合物,反应的方程式为: ,
,
故答案为:CH3CH(OH)COOH; ;
;
(3)由E到F反应的化学方程式是:nCH2=CHCOONa$\stackrel{一定条件}{→}$ ,F分子中的-COONa 具有亲水性,所以F能保水,
,F分子中的-COONa 具有亲水性,所以F能保水,
故答案为:nCH2=CHCOONa$\stackrel{一定条件}{→}$ ;-COONa 具有亲水性.
;-COONa 具有亲水性.
点评 本题考查有机物的推断,需要对给予的反应信息进行利用能较好的考查考生的阅读、自学能力和思维能力,是热点题型,注意掌握官能团的性质与转化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,零族元素的单质在常温下全部都是气体 | |
| B. | 同周期元素,ⅦA族的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3和H2CO3=CO2+H2O | |
| B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑和2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3和2SO3$\frac{\underline{催化剂}}{△}$2SO2+O2 | |
| D. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI和2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质(杂质) | C2H5OH (H2O) | CH3CH2OH (CH3COOH) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | c | b或d | b | b |
| 分离方法(2) | C | C | B | B |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L 0.1mol/L的NaCl溶液 | B. | 1L 0.2mol/L的MgCl2溶液 | ||
| C. | 1L 0.3mol/L盐酸溶液 | D. | 100mL 0.2mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 第一种方法 | C | 有机层(下层)无色 |
| 第二种方法 | D | 溶液呈血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com