
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
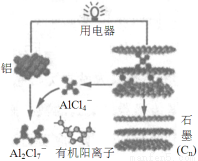
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e-+ 7AlCl4-= 4Al2Cl7-
D.充电时,AlCl4-向石墨电极方向移动
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
环保、安全的铝--空气电池的工作原理如图所示,下列有关叙述错误的是
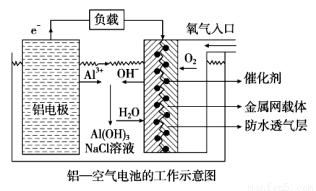
A.电池工作过程中,电解质溶液的pH不断增大
B.正极的电极反应式为O2 + 4e-+ 2H2O =4OH-
C.NaCl的作用是增强溶液的导电性
D.用该电池做电 源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g
源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:选择题
某有机化合物的结构简式如图所示,下列说法正确的是( )
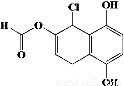
A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是 ( )
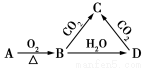
A.溶液呈碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气 体
体
D.受热易分解
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市高三上高考调研理综化学试卷(解析版) 题型:推断题
【化学—选修3:物质结构与性质】
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。H2SeO4的酸性比H2SeO3的强,其原因是 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32- 的立体构型是 。与SeO32- 互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于 晶体。
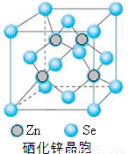
(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为 ;若该晶胞密度为ρg•cm-3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市高三上高考调研理综化学试卷(解析版) 题型:选择题
化学与社会、科学、技术、环境等有密切联系。下列有关说法正确的是
A.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
B.PM 2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C.新型材料聚酯纤维、光导纤维都属于有机高分子
D.在食品袋中放入盛有硅胶的透气袋,可防止食物氧化变质
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可大量共存
C.常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中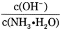 增大
增大
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
X、Y、Z都是气体,反应前X、Y的物质的量之比是1:2,在一定条件下可逆反应X+2Y?2Z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时X的转化率是( )
A.80% B.20% C.40% D.60%
查看答案和解析>>
科目:高中化学 来源:2017届湖南省株洲市高三上教学质检一化学试卷(解析版) 题型:填空题
氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
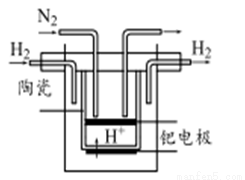
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。
(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I)  4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)  2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com