
【题目】1000ml某待测溶液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(每次实验所加试剂均过量):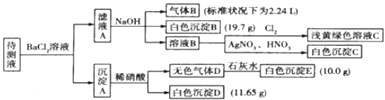
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:判断原溶液中K+是否存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是(写化学式).
【答案】
(1)HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
(2)Fe3+、Ba2+
(3)存在;由电荷守恒可知K+离子最小浓度为0.1mol/L
(4)CO32﹣、HCO3﹣、SO32﹣;BaCO3、BaSO3
【解析】解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣ , 向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣ , 可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+ , 加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣ , 一定不存在Fe3+ , 气体B为NH3 , 白色沉淀B为BaCO3 , 滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣ , 滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣ , 由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3﹣、Ba2+、OH﹣反应生成,反应离子方程式为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O,故答案为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O;(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+ , 故答案为:Fe3+、Ba2+;(3)由上述分析可知,不能确定原溶液中是否含有Cl﹣ , 溶液中一定没有Br﹣ . 若无色气体D是单一气体,则D为CO2 , E为CaCO3 , 溶液中含有CO32﹣ , 白色沉淀D只能为BaSO4 , 溶液中一定没有SO32﹣ , 一定含有SO42﹣ , B(碳酸钡)的物质的量= ![]() =0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)=
=0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)= ![]() =0.1mol/L,E(碳酸钙)的物质的量=
=0.1mol/L,E(碳酸钙)的物质的量= ![]() =0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)=
=0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)= ![]() =0.1mol/L,D(硫酸钡)的物质的量=
=0.1mol/L,D(硫酸钡)的物质的量= ![]() =0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)=
=0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)= ![]() =0.05mol/L, n(NH4+)=n(NH3)=
=0.05mol/L, n(NH4+)=n(NH3)= ![]() =0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+ , 当溶液中没有Cl﹣ , K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,故答案为:存在;由电荷守恒可知K+离子最小浓度为0.1mol/L;(4)由上述分析可知,溶液中一定含有CO32﹣、HCO3﹣ , 不能确定原溶液中是否含有Cl﹣ , 溶液中一定没有Br﹣ . 若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4 , 溶液中一定含有SO32﹣ , 不能确定是否含有SO42﹣ , 沉淀A中一定含有BaCO3 , BaSO3 , ①待测液中一定含有的阴离子是CO32﹣、HCO3﹣、SO32﹣ , 故答案为:CO32﹣、HCO3﹣、SO32﹣;②沉淀A中BaCO3 , BaSO3能与稀硝酸反应,故答案为:BaCO3、BaSO3 . 待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣ , 向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣ , 可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+ , 当溶液中没有Cl﹣ , K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,故答案为:存在;由电荷守恒可知K+离子最小浓度为0.1mol/L;(4)由上述分析可知,溶液中一定含有CO32﹣、HCO3﹣ , 不能确定原溶液中是否含有Cl﹣ , 溶液中一定没有Br﹣ . 若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4 , 溶液中一定含有SO32﹣ , 不能确定是否含有SO42﹣ , 沉淀A中一定含有BaCO3 , BaSO3 , ①待测液中一定含有的阴离子是CO32﹣、HCO3﹣、SO32﹣ , 故答案为:CO32﹣、HCO3﹣、SO32﹣;②沉淀A中BaCO3 , BaSO3能与稀硝酸反应,故答案为:BaCO3、BaSO3 . 待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣ , 向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣ , 可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+ , 加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣ , 一定不存在Fe3+ , 气体B为NH3 , 白色沉淀B为BaCO3 , 滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣ , 滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣ , 由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣ , 以此解答(1)、(2);(3)若无色气体D是单一气体,则D为CO2 , E为CaCO3 , 溶液中含有CO32﹣ , 白色沉淀D只能为BaSO4 , 溶液中一定没有SO32﹣ , 一定含有SO42﹣ , 计算B(碳酸钡)、E(碳酸钙)、硫酸钡的物质的量,根据离子守恒计算各离子的浓度;根据电荷守恒判断是否含有钾离子,若溶液含有K+ , 当溶液中没有Cl﹣ , K+离子浓度最小,根据电荷守恒计算;(4)若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4 , 溶液中一定含有SO32﹣ , 不能确定是否含有SO42﹣ , 沉淀A中一定含有BaCO3 , BaSO3 .


科目:高中化学 来源: 题型:
【题目】下列关于氯气、液氯、新制氯水和久置氯水的比较正确的是 ( )
A. 氯气、液氯、新制氯水和久置氯水中均含氯元素的单质
B. 氯气和久置氯水无漂白性,而液氯和新制氯水有漂白性
C. 久置氯水中无HClO,其他成分与新制氯水相同
D. 新制氯水和久置氯水均具对酸性,且后者酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体数目的叙述不正确的是( )
A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C.含有5个碳原子的某饱和链烃,其一氯代物有3种
D.菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要求设计实验证明:某种盐的水解是吸热的。有四位同学分别作出如下回答,其中不正确的是( )
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热的方法可以制备Fe(OH)3胶体,说明含Fe3+的盐水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是()
A.漂白粉的有效成分是Ca(ClO)2和CaCl2B.漂白粉在空气中久置后会变质
C.漂白粉的有效成分Ca(ClO)2不稳定,易分解D.漂白粉的主要成分是CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol NaHCO3 和一定量的Na2O2固体混合,在加热的条件下使其充分反应,经测定无Na2O2剩余,则最后所得固体的物质的量为( )
A.1 mol﹣2 mol之间
B.1mol﹣4mol之间
C.2 mol﹣4 mol之间
D.大于4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H﹣H键断裂时吸收热量为436kJ,求水蒸气中1mol H﹣O键形成时放出热量( )
A.463kJ
B.557kJ
C.486kJ
D.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中正确的是( )
A. 金属钠可以保存在少量水中 B. 金属钠是银白色, 但露置于空气中会变暗
C. 钠在空气中燃烧生成白色的 Na2O D. 钠投入CuSO4溶液中可观察到有红色物质析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com