
| A、废弃的金属、纸制品、塑料是可回收资源,玻璃不是可回收资源 |
| B、大力推广农作物的生物防治技术,以减少农药的使用 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、“低碳生活”倡导生活中耗用能量尽量减少从而减少CO2排放 |


科目:高中化学 来源: 题型:
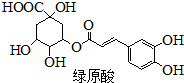 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A、奎尼酸分子式为C7H14O6 |
| B、绿原酸能发生取代、加成、消去和缩聚反应 |
| C、1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH |
| D、咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
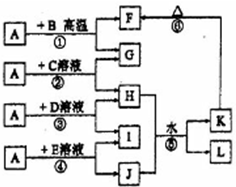 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Cl-、SO42- |
| B、K+、NH4+、OH-、NO3- |
| C、Na+、Ca2+、CO32-、Cl- |
| D、Na+、H+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16gO2中含有的氧气分子数为0.5NA |
| B、常温常压下,1molNe含有的原子数为NA |
| C、1.6gCH4中含有的甲烷分子数为0.1NA |
| D、1mol/LNaCl溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积Kw随温度、外加酸(碱)浓度的改变而改变 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、当弱电解质电离成离子的速率与离子结合成分子的速率相等时达到电离平衡状态 |
| D、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中的离子浓度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com