
 25℃时,在25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关比较正确的是( )
25℃时,在25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关比较正确的是( )| A、在A、B间任一点(不含A、B点),溶液中一定有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点,a=12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+) |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
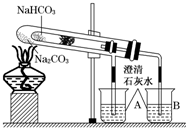 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知反应C(s)+H2O(g)=CO(g)+H2(g)在一定温度下非自发,则该反应△H>0 |
| B、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va:Vb=10:9 |
| C、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F一)]<[c(K+)-c(CH3COO-)] |
| D、已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
| A、正戊烷的燃烧热大约是3540kJ/mol |
| B、热稳定性:正丁烷>异丁烷 |
| C、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ/mol |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、3mol |
| C、4mol | D、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.37 | 0.74 | 0.75 | 0.82 | 1.10 | 0.99 |
| 主要化合价 | +1 | -2 | +5、-3 | +3 | +5、-3 | +7、-1 |
| A、X→T原子序数依次增大 |
| B、上述六种元素都是非金属元素 |
| C、元素X、Y、Q形成的化合物水溶液呈碱性 |
| D、元素R的最高氧化物的水化物的酸性比元素Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl和HCl |
| B、NH2OCl和HCl |
| C、NH3和HClO |
| D、NH3?H2O和HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com