
| A. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨的键能大 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
分析 A、燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,H生成液态水;
B、依据能量越高越活泼分析判断;
C、强酸和强碱反应生成1mol水放出的热量为中和热;
D、一氧化碳燃烧生成二氧化碳过程是放出热量.
解答 解:A、燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,H燃烧生成液态水,故A错误;
B、已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高于石墨,所以金刚石比石墨的键能小,故B错误;
C、已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故C正确;
D、已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,所以△H1<△H2,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法,燃烧热,中和热概念分析应用,掌握概念实质是关键,题目难度中等.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化学反应的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是化学反应中发生能量变化的主要原因 | |
| C. | HCl(aq)和NaOH(aq)反应的中和热为57.3 kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1 mol H2O(l)时,放出的热量为57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池正极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 该电池工作时电流由Zn经导线流向MnO2 | |
| D. | 该电池中Zn作负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
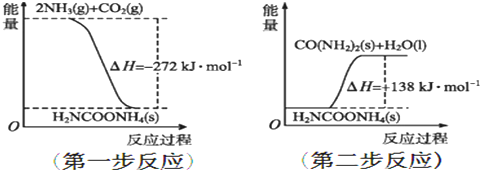
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
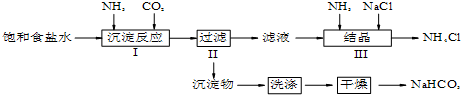
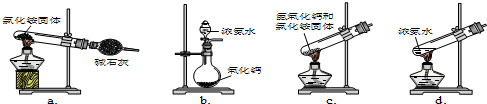
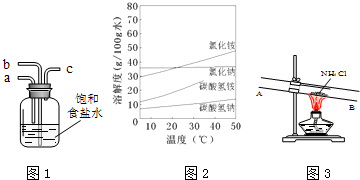
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com