
下图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质。
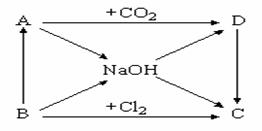 |
(1)写出C的化学式: 。
(2)写出实现下列变化的化学方程式:
① B → NaOH: ,
② A → D: ,
(3)浓NaOH溶液能跟地壳中含量最多的金属元素的单质反应,写出该反应的离子方程式: 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) CH3OH(g)。
(1) 分析该反应并回答下列问题:
① 平衡常数表达式为K= 。
② 下列各项中,不能够说明该反应已达到平衡的是______________(填序号)。
a. 恒温、恒容条件下,容器内的压强不发生变化
b. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c. 一定条件下,CO、H2和CH3OH的浓度保持不变
d. 一定条件下,单位时间内消耗2mol CO,同时生成1 mol CH3OH
(2) 下图是该反应在不同温度下CO的转化率随时间变化的曲线。
① 该反应的焓变ΔH____________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a. 升高温度b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂d. 充入He,使体系总压强增大
(3) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH=-b kJ·mol-1
③ H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH=______________kJ·mol-1。
(4) 2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
① 该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
② 该电池正极的电极反应式为:_______________________________。
③ 工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(5) 以上述电池做电源,用上图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_______________________________________________________,
_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修物质结构与性质](15分)
美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是____。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:____________。
②乙醇沸点比氯乙烷高,主要原因是 ____________。
③上图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳源中属于非极性分子的是___(a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
查看答案和解析>>
科目:高中化学 来源:2011届山东省济南市高三教学质量调研(一模)化学试卷 题型:填空题
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) 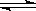 CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K= 。
②下列各项中,不能够说明该反应已达到平衡的是______________(填序号)。
a. 恒温、恒容条件下,容器内的压强不发生变化
b. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c. 一定条件下,CO、H2和CH3OH的浓度保持不变
d. 一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。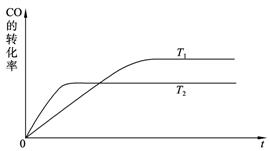
①该反应的焓变ΔH____________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
a. 升高温度b. 将CH3OH(g)从体系中分离
c. 使用合适 的催化剂d. 充入He,使体系总压强增大
的催化剂d. 充入He,使体系总压强增大
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH=-b kJ·mol-1
③ H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH=______________kJ·mol-1。
(4) 2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。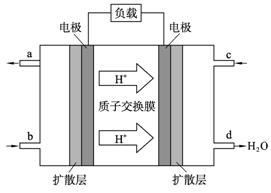
①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
②该电池正极的电极反应式为:_______________________________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。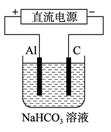
(5)以上述电池做电源,用上图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_______________________________________________________,
_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省济南市高三教学质量调研(一模)化学试卷 题型:填空题
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) 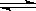 CH3OH(g)。
CH3OH(g)。
(1) 分析该反应并回答下列问题:
① 平衡常数表达式为K= 。
② 下列各项中,不能够说明该反应已达到平衡的是______________(填序号)。
a. 恒温、恒容条件下,容器内的压强不发生变化
b. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c. 一定条件下,CO、H2和CH3OH的浓度保持不变
d. 一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2) 下图是该反应在不同温度下CO的转化率随时间变化的曲线。
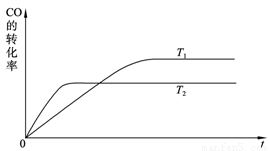
① 该反应的焓变ΔH____________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a. 升高温度b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂d. 充入He,使体系总压强增大
(3) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH =-a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
③ H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH=______________kJ·mol-1。
(4) 2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

① 该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
② 该电池正极的电极反应式为:_______________________________。
③ 工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。

(5) 以上述电池做电源,用上图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_______________________________________________________,
_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高考复习质量监测(理综)化学部分 题型:填空题
(15分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
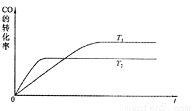
①该反应的焓变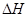 0(填“>”、“<”或“=”)。
0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1 K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是 。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)已知在常温常压下
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)
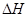 =-akJ·mol-1
=-akJ·mol-1
②2CO(g)+O2(g)=2CO2(g)
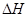 =-bkJ·mol-1
=-bkJ·mol-1
③H2O(g)=H2O(1)
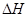 =-ckJ·mol-1
=-ckJ·mol-1
则,CH3(OH)(1)+O2(g)=CO(g)+2H2O(1)
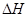 = kJ·mol-1
= kJ·mol-1
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
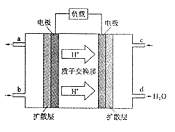
①该电池工作时,b口通入的物质为 ,c口通入的
物质为 。
②该电池正极的电极反应式为: 。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,
有 NA个电子转移。
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
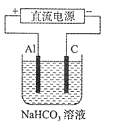
, 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com