
准确称量2.0g硫酸铵样品放入烧杯中,加入足量的碱液,高温加热至沸腾,将逸出的氨气吸收在100ml0.25mol/L的硫酸溶液中,然后用0.50mol/LNaOH溶液进行滴定,当滴入40.00ml时恰好完全中和.则原硫酸铵样品的纯度是 .
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:阅读理解
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源:2010年辽宁省东北育才学校高二下学期期中考试化学试题 题型:实验题
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。现利用如图装置制取苯甲酸甲酯粗产品,再测定苯甲酸甲酯的含量。
实验一:制取苯甲酸甲酯
在圆底烧瓶中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A(用酒精灯加热略)连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为 。
(2)要想提高苯甲酸的转化率,可以采取的措施是 。
实验二:为测定苯甲酸甲酯的含量,进行了如下操作:
(I)准确称量30.0g苯甲酸甲酯粗品于锥形瓶中,用0.50mol/L 滴定(酚酞做指示剂)。终点时消耗
滴定(酚酞做指示剂)。终点时消耗 溶液的体积为40.0mL;
溶液的体积为40.0mL;
(II)另取30.0g苯甲酸甲酯粗产品于250ml锥形瓶中,加入100ml2.1mol/L 溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L
溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L 滴定过量的
滴定过量的 。终点时消耗盐酸的体积为20.0ml。回答:
。终点时消耗盐酸的体积为20.0ml。回答:
(3)实验(I)中达到滴定终点时的现象是
(4)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(5)利用实验(I)、(II)测量的数据计算粗产物中苯甲酸甲酯的质量分数为 。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,需要测量的实验数据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
 (08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
(08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。
⑴写出此反应的化学方程式
;
该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是
;
⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不
振荡该试管,可看到的现象是 ,若振
荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ;
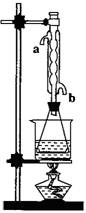 ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
一条改进意见:
。
⑷为测定乙酸乙酯的含量,进行了如下操作:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为
40.0mL;
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol/LNaOH溶液混合均匀后,装上冷凝管,在水浴上加热回
流约1小时,装置如图所示。待冷却后,用0.50mol/LHCl滴定
过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答:
①实验(I)中达到滴定终点时的现象是 。
②实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
③利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。现利用如图装置制取苯甲酸甲酯粗产品,再测定苯甲酸甲酯的含量。
实验一:制取苯甲酸甲酯
在圆底烧瓶中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A(用酒精灯加热略)连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为 。
(2)要想提高苯甲酸的转化率,可以采取的措施是 。
实验二:为测定苯甲酸甲酯的含量,进行了如下操作:
(I)准确称量30.0g苯甲酸甲酯粗品于锥形瓶中,用0.50mol/L![]() 滴定(酚酞做指示剂)。终点时消耗
滴定(酚酞做指示剂)。终点时消耗![]() 溶液的体积为40.0mL;
溶液的体积为40.0mL;
(II)另取30.0g苯甲酸甲酯粗产品于250ml锥形瓶中,加入100ml2.1mol/L![]() 溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L
溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L![]() 滴定过量的
滴定过量的![]() 。终点时消耗盐酸的体积为20.0ml。回答:
。终点时消耗盐酸的体积为20.0ml。回答:

(3)实验(I)中达到滴定终点时的现象是
(4)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(5)利用实验(I)、(II)测量的数据计算粗产物中苯甲酸甲酯的质量分数为 。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,需要测量的实验数据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com