
【题目】能正确表示下列反应的离子方程式的是
A. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B. 铜片与浓HNO3:Cu+NO3-+4H+===Cu2++NO↑+2H2O
C. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-![]() NH3·H2O
NH3·H2O
D. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【答案】A
【解析】
A、硝酸具有氧化性,能将亚铁离子氧化;
B、浓硝酸参加反应生成的还原产物是二氧化氮;
C、氯化铵溶液和浓氢氧化钠溶液混合后加热会产生氨气;
D、碳酸氢铵溶液与足量氢氧化钠溶液混合后,碳酸氢根、铵根离子均能和氢氧根之间发生反应.
A、向Fe(NO3)2稀溶液中加入盐酸,溶液中含有亚铁离子和硝酸,硝酸具有氧化性,能将亚铁离子氧化三价铁,自身被还原为一氧化氮,故A正确;
B、浓硝酸参加反应生成的还原产物是二氧化氮,铜与浓硝酸反应为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,故B错误;
C、氯化铵溶液和浓氢氧化钠溶液混合后加热会产生氨气,即NH4++OH-![]() NH3↑+H2O,故C错误;
NH3↑+H2O,故C错误;
D、碳酸氢铵溶液与足量氢氧化钠溶液混合后,碳酸氢根、铵根离子均能和氢氧根之间发生反应,即HCO3-+NH4++2OH-![]() NH3↑+2H2O+CO32-,故D错误。
NH3↑+2H2O+CO32-,故D错误。
故选:A。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷(C3F8)的电子式为: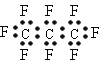
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷(C3F8)分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔质量就等于物质的相对分子质量或相对原子质量
B. 摩尔质量就是物质相对分子质量的6.02×1023倍
C. HNO3的摩尔质量是63 g
D. 硫酸和磷酸(H3PO4)的摩尔质量相等,都是98 g·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,恒容密闭容器中,发生反应:X(g)+Y(g)![]() Z(g)
Z(g) ![]() ,各物质的浓度随时间变化如图所示。
,各物质的浓度随时间变化如图所示。

(1)从反应开始到4min时平衡,X的平均反应速率为________________。
(2)根据图像数据,4min时平衡常数K=________________。
(3)若使平衡时体系中c(X)=c(Z),则改变条件为 ________________。(只写一项)
(4)若某时刻,v正(Y)=2v逆(Z),则反应___________达平衡(填“已”或“未”)
(5)图中a.b对应的正反应速率大小关系为va_____vb(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )
A. 氢气通入Al2O3并加热 B. 加热HgO
C. 电解熔融的MgCl2 D. 铝粉和Fe2O3共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应: 2SO3 (g)![]() 2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是
2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是

A. 0~8min内v(SO3)=0.025mol/(L·min)
B. 8min时,v逆(SO2)=2v正(O2)
C. 8min时,容器内压强保持不变
D. 若8min时将容器压缩为1L,n(SO3)的变化如图中a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是 ( )

A. 莽草酸和达菲互为同系物
B. 莽草酸既能与H2发生加成,又能与FeCl3溶液反应显紫色
C. 莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色
D. 1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中应用广泛。
Ⅰ.某兴趣小组探究SO2气体还原Fe3+、I2。

(1)写出A中反应的离子方程式: ______________________________________。
(2)通入足量SO2后,装置B中的现象是 _________________________________;
(3)装置C的作用是 ___________________________________________________。
Ⅱ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠(Na2S2O5),大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:Na2S2O5溶于水会生成NaHSO3。检验Na2S2O5晶体在空气中已被氧化的实验方法是_______________________________________ 。
III. 实验室需要1.0mol·L-1硫酸溶液480 mL,根据溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________ (填字母),配制上述溶液还需用到的玻璃仪器是__________________________________________(填仪器名称)。

(2)应该用量筒量取 _______mL质量分数为98%、密度为1.84 g·cm-3的浓硫酸。
(3)在配制上述溶液的实验中,下列操作引起结果偏高的有 _______(填字母序号)。
A.若容量瓶用蒸馏水洗涤后未干燥
B.若定容时,俯视液面加水至刻度线
C.若用量筒量取浓硫酸时,俯视读数
D.若浓硫酸稀释后未冷却,立即转移到容量瓶中并定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com