
分析 已知:①NH3(g)+HCl═NH4Cl(s);△H=-176kJ/mol
②NH3(g)+H2O(l)═NH3(aq);△H=-35.1kJ/mol
③HCl(g)+H2O═HCl(aq);△H=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律,④-①+②+③可得:NH4Cl(s)+2H2O(l)═NH4Cl(aq),焓变也进行需要的计算.
解答 解:已知:①NH3(g)+HCl═NH4Cl(s);△H=-176kJ/mol
②NH3(g)+H2O(l)═NH3(aq);△H=-35.1kJ/mol
③HCl(g)+H2O═HCl(aq);△H=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律,④-①+②+③可得:NH4Cl(s)+2H2O(l)═NH4Cl(aq),故△H=(-52.3kJ/mol)-(-176kJ/mol)+(-35.1kJ/mol)+(-72.3kJ/mol)=+16.3kJ/mol,
故答案为:+16.3 kJ/mol.
点评 本题考查运用盖斯定律进行反应热的计算,难度中等,根据已知方程式构造目标方程式是关键.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
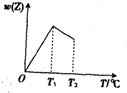 由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C5H12分子中,含17×6.02×1023个共用电子对 | |
| B. | 10 mL 18.4 mol•L-1的浓硫酸与90 mL蒸馏水混合,所得溶液中c(H+)=3.68 mol•L-1 | |
| C. | 25℃时,在pH=4的HCl溶液与pH=10的Na2CO3溶液中,水电离出的c(H+)前者大于后者 | |
| D. | 25℃时,在25 mL 0.1 mol•L-1NaOH溶液中,滴入0.1 mol•L-1的CH3COOH溶液至混合溶液pH=7时,则滴加CH3COOH溶液的体积大于25 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com