
分析 (1)盐酸溶液中氯化氢为强电解质完全电离,醋酸为弱电解质存在电离平衡;
(2)①盐酸溶液中滴入石蕊试液变红色,加入相同离子观察红色变化分析判断是否含电离平衡;
②醋酸溶液中滴入石蕊试液变红色,加入醋酸钠观察红色变化判断是否存在电离平衡.
解答 解:(1)盐酸溶液中氯化氢为强电解质完全电离,电离方程式为:HCl=H++Cl-;,醋酸为弱电解质存在电离平衡,电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:HCl=H++Cl-; CH3COOH?CH3COO-+H+;
(2)①盐酸中不存在电离平衡:取适量盐酸于试管中,先滴加2滴石蕊试液,溶液变红色,再加入固体氯化钠,溶解后氯离子对溶液红色变化的影响,观察到溶液盐酸不变,说明溶液中不存在电离平衡,故选B、G、M,
故答案为:B; G; M;
②醋酸溶液中滴入石蕊试液变红色,醋酸中存在电离平衡:取适量醋酸于试管中,先滴加2滴石蕊试液溶液变红色,再加入醋酸钠固体,溶解后醋酸根离子影响平衡,若观察到溶液红色变浅说明醋酸溶液中存在电离平衡,故选B、H、L,
故答案为:B; H;L.
点评 本题考查了电解质电离平衡的影响因素、电离平衡的验证,掌握基础是解题关键,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:实验题
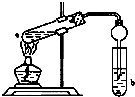 如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C2H4 | B. | C2H2和C2H4 | C. | C2H4和C2H6 | D. | C4H8和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
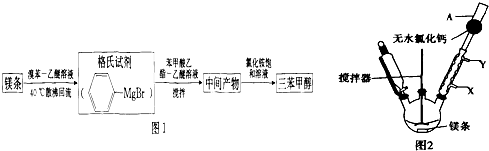
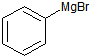 +H2O→
+H2O→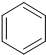 +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com