
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
分析 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则X为C元素;Y原子核外的L层有3个未成对电子,则Y为N元素;Z在元素周期表的各元素中电负性仅小于氟,则Z为O元素;Q单质常温、常压下是气体,原子的M层上有1个未成对的p电子,则Q为Cl元素;R核电荷数是Y与Q的核电荷数之和,其核电荷数是24,为Cr元素;E原子序数比R大3,则E为Co元素.
(1)原子核外有几个电子就有几种不同运动状态的电子,N原子核外有1s、2s、2p能级;
(2)同一周期元素,元素的电负性随着原子序数增大而增大;
(3)氢化物的相对分子质量越大,熔沸点越高,但含有氢键的氢化物熔沸点较高;
(4)Cr的最高化合价为+6,R的一种配合物的化学式为RCl3•6H2O,0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀,说明该配合物的氯离子个数是2,另外1个氯原子为内界;
(5)元素Co能形成八面体构型的配合物离子[Co(NH3)xCl2]+,一个氯离子带一个单位负电荷,根据配合物离子电荷确定中心离子电荷,配位体为氨气、氯离子,配离子为八面体构型,则钴离子配位数为6;
(6)Y的最低价氢化物为NH3,与氧元素的一种氢化物反应,生成的两种产物均不污染环境,则氧元素氢化物为H2O2,应生成氮气与水.
解答 解:X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则X为C元素;Y原子核外的L层有3个未成对电子,则Y为N元素;Z在元素周期表的各元素中电负性仅小于氟,则Z为O元素;Q单质常温、常压下是气体,原子的M层上有1个未成对的p电子,则Q为Cl元素;R核电荷数是Y与Q的核电荷数之和,其核电荷数是24,为Cr元素;E原子序数比R大3,则E为Co元素.
(1)原子核外没有运动状态相同的电子,原子核外有几个电子就有几种不同运动状态的电子,所以N原子核外电子有7种运动状态,N原子核外有1s、2s、2p能级,有3个能级,故答案为:7;3;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,所以C、N、O元素元素电负性大小顺序是O>N>C,故答案为:O>N>C;
(3)水中含有氢键,氯化氢和甲烷中都不含氢键,故水的熔沸点最高,且氯化氢相对分子质量大于甲烷,氯化氢的熔沸点高于甲烷的,所以这三种元素氢化物熔沸点高低顺序是H2O>HCl>CH4,故答案为:H2O>HCl>CH4;
(4)R为Cr元素,价电子排布为3d54s1,最高正化合价为+6,0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O,
故答案为:+6;B;
(5)元素E能形成八面体构型的配合物离子[Co(NH3)xCl2]+,则配离子中Co元素表现+3价,故则中心离子为Co3+,配体为NH3和Cl-,配离子为八面体构型,6钴离子配位数为6,x的值为4,
故答案为:Co3+;NH3和Cl-;4;
(6)Y的最低价氢化物为NH3,与氧元素的一种氢化物反应,生成的两种产物均不污染环境,则氧元素氢化物为H2O2,应生成氮气与水,反应方程式为:2NH3+3H2O2═N2+6H2O,
故答案为:2NH3+3H2O2═N2+6H2O.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电负性、配合物、元素化合物性质等,难度中等,明确元素种类是关键,(5)中注意配合物中外界离子与配体性质区别,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3;Fe2O3 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)3Fe(OH)2;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
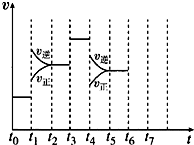 在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液(I2)用CCl4萃取 | B. | NO(NH3)通过水洗涤 | ||
| C. | NaCl(NH4Cl)加热固体混合物 | D. | N2(NO2)通过水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H ++Cl -+ClO - | |
| B. | Na2CO3溶液中CO32的水解:CO32-+H2O═HCO32-+OH - | |
| C. | 酸性溶液中KIO3与KI反应生成I 2:IO3-+I -+6H +═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO32-+Ba2++OH -═BaCO3↓+H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | H2O既有氧化性又有还原性 | |
| D. | KMnO4是一种强氧化剂,没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
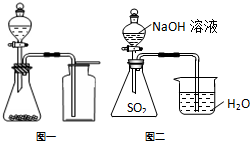
| A. | 氯气通入澄清石灰水中,制取漂白粉 | |
| B. | 可通过化合反应得到Fe(OH)3 | |
| C. | 选择合适的试剂,用图一所示装置可分别制取少量CO2、NO和O2 | |
| D. | 用图二的装置可证明SO2与NaOH发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①达到平衡时,增大压强平衡不移动 | |
| B. | 反应②的平衡常数表达式为K=$\frac{c(C{O}_{2})•c(S{O}_{2})}{C(CO)}$ | |
| C. | 反应①和②是主反应,反应③是副反应 | |
| D. | 2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com