
下列电离方程式错误的是 ( )
A.Al2(SO4)3=2Al3+ + 3SO42-
B.NaHCO3=Na+ + H+ + CO32-
C.Ba(OH)2= Ba2+ + 2 OH-
D.NaHSO4=Na++H++SO42-
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(16分)粗食盐中除含有泥沙等不溶性杂质外,还含有钙离子、镁离子、硫酸根离子等可溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④过滤;⑤滴入稀盐酸至无气泡产生;⑥蒸发结晶。
回答下列问题。
(1)步骤①中的BaCl2 溶液还可以换成__________(填字母)。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以
(2)步骤③中所发生反应的离子方程式为__________________________、________________________。
(3)步骤⑥需使用玻璃棒,其目的是________________________________________________________。
(4)步骤①、步骤②、步骤③的顺序还可以是______________________或________________________。
(5)用上述过程中获得的精盐配制240mL 0.8mol·L-1 NaCl溶液,步骤如下:计算→称量→溶解→转移→洗涤→定容→摇匀。
a.需要的NaCl固体质量为_________g;
b.定容时,当液面离刻度线1~2cm时应改用_________(填仪器名称)加水。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
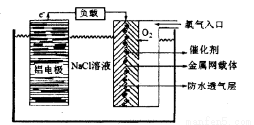
①该电池的总反应化学方程式为____ ;
②电池中NaCI的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mloI·L-1H2SO4溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、HCO3-
C.0.l mol·L-lNaClO溶液:Fe2+、K+、I一、Cl-
D.c(OH-)/c(H+)=lxl014的溶液:Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(8分)在400 mL2 mol·L-1H2SO4溶液中, H+的物质的量浓度为 ,
SO42-的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
(12分)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
A.减压 B.增加NH3的浓度 C.升温 D.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.K2FeO4具有还原性,可用于自来水的杀菌消毒
C.浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸
D.SO2具有漂白性,能使紫色KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:填空题
(16分)A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com