
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 1mol甲基含10NA个电子
B. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA
C. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA
D. 15 g C2H6中含有共价键数目为3NA
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中T所处的周期序数与族序数相等。下列判断错误的是
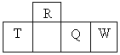
A. W和R形成的化合物属于分子晶体
B. 元素R与氢形成的化合物有很多种
C. 含T的盐溶液可能能与NaOH溶液反应也可能与盐酸反应
D. 常温下,T的单质与W的最高价氧化物对应水化物的浓溶液反应产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,无水硫酸铜粉末为受热分解生成CuO和气体A。气体A为SO2、SO3和O2中的一种或几种。请回答:
(1)只用一种试剂就能证明气体A中是否含有SO2,该试剂可以是__________;
a. 石蕊溶液 b. 品红溶液 c. 氯化钡溶液 d. 酸性高锰酸钾溶液
(2)对气体A的合理组成进行如下假设:
①只有SO3一种气体;②只有两种气体;③三种气体都有
若假设②成立,写出无水硫酸铜受热分解的反应方程式___________;
(3)若气体A中SO2、SO3和O2都有,用如图所示装置定量测定经NaOH溶液吸收后剩余气体体积(气体体积最后换算为标准状况)。
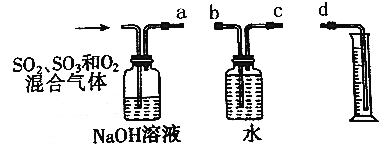
①装置的连接顺序为____________;(用字母表示);
②实验中测定的是_________气体的体积;
③实验发现测定结果比理论值明显偏低,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与一定量浓H2SO4充分在加热下反应生成会SO2和H2的混合气体。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中含有SO2和H2。取一定量的Zn置于b中,向a中加入100mL 18mol·L-1的浓硫酸,经过一段时间,恰好完全反应。
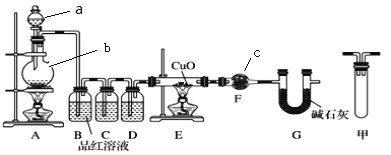
①填写仪器名称:c___________。
②实验开始前应先检验装置的气密性,请回答如何检验装置A的气密性___________。
③用化学方程式表示产生SO2的原因______________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥实验结束后测得装置F增重18.0g,计算实验开始时加入的Zn的质量为________g。你认为实际消耗Zn的质量应比计算值____________。(填“大”、“小”或“相同”)
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
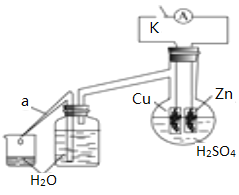
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100mL 1mol/L 的盐酸,恰好使混合物完全反应,放出 11.2mL(标准状况)气体,所得溶液加入 KSCN 溶液不变红色。用足量的CO 在高温下还原相同质量的此混合物,所得铁的质量为
A. 2.8g B. 11.2g C. 5.6g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式为 (未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
A. H2B. Br2的CCl4溶液
C. HBrD. Ag(NH3)2OH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 将0.1 mol的镁、铝混合物溶于100mL 2mol·L-1的H2SO4溶液中,然后再滴加1mol·L-1的NaOH溶液。请回答:(不需要写出计算过程)
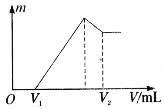
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中n(Mg)=________mol,
mL时,则金属粉末中n(Mg)=________mol,![]() _______mL。
_______mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有______________
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有______________
②下列操作会使所配的溶液浓度偏小的是___________(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
II(1)在100 g物质的量浓度为cmol/l,密度为pg/ mL的硫酸中加入一定量的水稀释成0.5cmol/L的硫酸,则加入水的体积________100 mL (填 “== ”“< ” “ >” 下同)
(2)若把(1)中的硫酸改成氨水,应加入水的体积______100 mL
(3)若把(1)、(2)中物质的量的浓度均改为溶质的质量分数,则加入水的体积_____100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间物 ![]() 的合成路线如下:
的合成路线如下:

已知:![]() 。
。
(1)A的系统命名为____________________。
(2)![]() 含有的官能团为______________________________。
含有的官能团为______________________________。
(3)写出③⑥的反应类型分别为__________、__________。
(4)反应④的化学方程式为_____________________________________________。
(5)![]() 的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
(6)请设计合理方案用![]() 合成
合成![]() (其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
(其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com