
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制取N2O气体。
(1)连二次硝酸中氮元素的化合价为_______。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
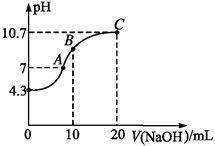
①写出H2N2O2在水溶液中的电离方程式:_________。
②B点时溶液中c(H2N2O2)___ c(N2O22-)(填“>”、“<”或“=”)。
③A点时溶液中c(Na+)___(HN2O22-)+c(N2 O22-)(填“>”、“<”或“=”)。
(3)已知常温下Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2N2O2)=4.2×10-9。硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中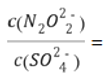 ____。
____。
【答案】 +1价 H2N2O2![]() HN2 O2-+H+ HN2O2-H++N2O22- > > 3.0×10-4
HN2 O2-+H+ HN2O2-H++N2O22- > > 3.0×10-4
【解析】(1)根据化合价代数和为零计算N的化合价。
(2)①0.01mol/L的H2N2O2溶液pH=4.3,所以属于二元弱酸,存在电离平衡。
②酸剩余,得到等浓度的H2N2O2和NaHN2O2的混合液,溶液显示碱性,则HN2O2-的水解程度大于H2N2O2的电离程度。
③电荷守恒可知c(Na+)>c(N2O22-)+c(HN2O2-)。
(3)根据Ksp(Ag2N2O2)=c2(Ag+)·c(N2O22-)=4.2×10-9,Ksp(Ag2SO4)=c2(Ag+)·c(SO42﹣)=1.4×10-5,进行计算。
(1)根据化合价法则:连二次硝酸(H2N2O2)中,氢为+1价,氧为-2价,所以氮元素化合价为+1价;正确答案:+1价。
(2)①0.01mol/L的H2N2O2溶液pH=4.3,所以属于二元弱酸,在水溶液中的电离分步进行,电离程度弱,应该是可逆的过程,其电离方程式为:H2N2O2H++HN2O2-、HN2O2-H++N2O22-;正确答案:H2N2O2![]() HN2O2-+H+ 、HN2O2-H++N2O22-。
HN2O2-+H+ 、HN2O2-H++N2O22-。
②10mL0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L﹣1H2N2O2溶液,酸剩余,得到等浓度的H2N2O2和NaHN2O2的混合液,溶液显示碱性,则HN2O2-的水解程度大于H2N2O2的电离程度,c(H2N2O2)>c(N2O22﹣);正确答案:>。
③根据该点溶液显示中性,c(OH﹣)=c(H+),根据电荷守恒:c(Na+)+c(H+)=2c(N2O22-)+c(OH-)+c(HN2O2-),所以c(Na+)=2c(N2O22-)+c(HN2O2-),即c(Na+)>c(N2O22-)+c(HN2O2-);正确答案:>。
(3)根据Ksp(Ag2N2O2)=c2(Ag+)·c(N2O22-)=4.2×10-9,Ksp(Ag2SO4)=c2(Ag+)·c(SO42﹣)=1.4×10-5,两式相除得到:c(N2O22-)/c(SO42-)= Ksp(Ag2N2O2)/ Ksp(Ag2SO4)= 4.2×10-9/1.4×10-5=3.0×10-4;正确答案:3.0×10-4。


科目:高中化学 来源: 题型:
【题目】核磁共振谱(NMR)是研究有机化合物结构的最有力手段之一。在所研究化合物的分子中,每一种结构类型的等价(或称为等性)H原子,在NMR谱中都给出相应的峰(信号).谱中峰的强度是与分子中给定类型的H原子数成比例的。例如,乙醇的NMR谱中有三个信号,其强度比为3:2:1。
(1)在常温下测得的某烃C8H10(不能与溴水反应)的NMR谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为________________________;该烃在光照下生成的一氯代物在NMR谱中可产生_________种信号,强度比为__________。
(2)在常温下测定相对分子质量为128的某烃的NMR,观察到两种类型的H原子给出的信号,其强度之比为9:1,若为链烃,则该烃的结构简式为________________,其名称为_______________。观察到两种类型的H原子给出的信号,其强度之比为1:1,若为芳香烃,则该烃的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列电化学装置说法正确的是
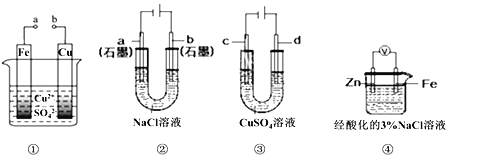
A. 装置①中,构成电解池时Fe极质量既可增也可减
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 用装置③精炼铜时,d极为精铜
D. 装置④中电子由Fe经导线流向Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
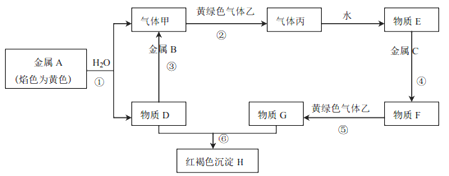
请回答下列问题:
(1)写出 B、乙的化学式:B______、乙________, E的名称:________。
(2)写出下列反应的化学方程式:
反应⑤ _______________;
反应⑥________________。
(3)写出下列反应的离子方程式:
反应①___________;
反应③______________;
(4)若向F的溶液中滴入适量D的溶液,现象是:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下产生2.8L氢气和 0.25 mol ACln;B的气态氢化物的分子式为 H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1: 2.88,B原子核内质子数与中子数相等;C和B可形成液态化合物 CB2,并能溶解B的单质。试回答下列问题:
(1)A、B、C的名称分别是______、______、________;
(2) A离子的结构示意图为_______; B在周期表中的位置为_______;CB2的分子式为_______。
(3)A与B形成的化合物的化学式为_________
(4)B的最高价氧化物的水化物的化学式为_________,
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. F2、Cl2、Br2、I2的氧化性逐渐增强
B. VIA族元素的原子,其半径越大,越容易得到电子
C. 同周期元素中,VIIA族元素的原子半径最大
D. 元素周期表中从IIIB到IIB的10个纵列的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A.它的最外层电子数为4B.它的金属性比铅强
C.它具有+2、+3、+4价D.它的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 人类历史上使用最早的合金是青铜
B. 钢属于铁合金
C. 目前世界上使用量最大的合金是铝合金
D. 目前世界上用途最广的是合金钢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com