
在固定容积的密闭容器中,可逆反应2X(?)+Y(g) Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
A.正反应为放热反应,X可能是气态、液态或固态 B.正反应为放热反应,X一定为气态
C.若X为非气态,则正反应为吸热反应 D.若加入少量的Z,该平衡向左移动
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×12-12mol2·L-2、5.0×12-13mol2·L-2、8.3×12-17mol2·L-2。下列有关说法错误的是 ( )
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究学习小组用下图所示装置进行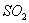 、
、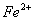 和
和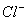 还原性强弱比较实验,实验过程如下:
还原性强弱比较实验,实验过程如下:
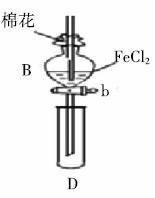
I. 先向B中的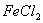 溶液(约
溶液(约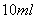 )中通入
)中通入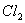 ,当B的溶液变黄时,停止通气。
,当B的溶液变黄时,停止通气。
II. 打开活塞b,使约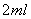 的溶液流入D试管中,检验取出溶液中的离子。
的溶液流入D试管中,检验取出溶液中的离子。
III. 接着再向B中通入一定量的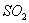 气体。
气体。
IV. 更新试管D,重复过程II,检验取出溶液中的离子。
(1)仪器B的名称是__________,棉花中浸润的溶液为__________,目的是__________。
(2)实验室制备氯气的化学方程式为__________。
(3)过程III中一定发生反应的离子方程式为__________,过程IV中检验取出溶液中是否含有硫酸根的操作是____________________。
(4)该小组对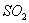 、
、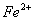 和
和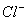 还原性强弱比较期望达到的结论是:______________。
还原性强弱比较期望达到的结论是:______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明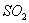 、
、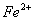 和
和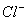 还原性强弱关系的是____________________。
还原性强弱关系的是____________________。
| 过程II中检出离子 | 过程IV中检出离子 | |
| 甲 | 有 | 有 |
| 乙 | 既有 | 有 |
| 丙 | 有 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A.Fe3O4 + 4CO = 3Fe + 4CO2 △H= -14kJ·mol-1
B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -22kJ·mol-1
C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= +14kJ·mol-1
D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -14kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
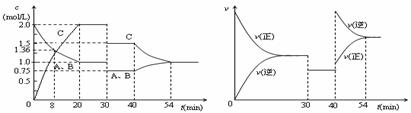
A.第8min时 A的反应速率为0.08mol·L-1·min-1
B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4
C.30min时改变的条件是降低温度,40min时改变的条件是升高温度
D.反应方程式中的x=1,且正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为______________。
⑵高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是______________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 ______________。


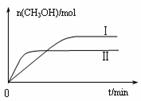
图1 图2 图3
⑶二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如右图所示(无被省略的物质): 又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
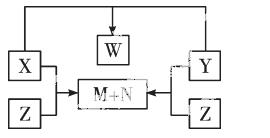
(1)上述转化关系图中涉及的基本反应类型是 ;
(2)X、Y、Z、W的化学式依次是:
X 、Y 、Z 、W ;
(3)写出X与Y、X与Z反应的化学方程式:
X+Y: ;
 X+Z: 。
X+Z: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A. 元素的单质一定由氧化或还原该元素的化合物制得
B. 含有最高价元素的化合物不一定具有很强的氧化性
C. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com