
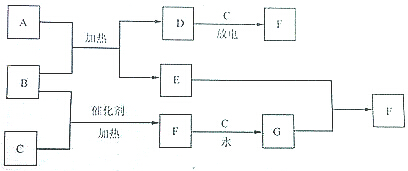
 中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂.
中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂. .
.分析 B为无色有刺激性气味的气体,且其水溶液呈碱性,则B为NH3;C、D均为无色的气体单质,C具有助燃性,则C为O2,D是大气中含量最多的物质,则D为N2,E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂,则E为Cu,A为黑色金属氧化物的固体,则A为CuO,氮气与氧气放电产生F为NO,NO与氧气和水反应生成G为HNO3,据此答题.
解答 解:B为无色有刺激性气味的气体,且其水溶液呈碱性,则B为NH3;C、D均为无色的气体单质,C具有助燃性,则C为O2,D是大气中含量最多的物质,则D为N2,E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂,则E为Cu,A为黑色金属氧化物的固体,则A为CuO,氮气与氧气放电产生F为NO,NO与氧气和水反应生成G为HNO3,
(1)D为N2,D的电子式为 ,
,
故答案为: ;
;
(2)氨气遇到蘸有浓盐酸的玻璃棒时,氨气与氯化氢反应生成氯化铵,可看到有白烟出现,
故答案为:白烟出现;
(3)C为O2,在实验室,用双氧水制取氧气,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)E为Cu,G为HNO3,E与G溶液反应生成NO的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,题目难度中等,以物质的颜色和化学性质等为突破口进行推断,侧重考查元素化合物性质,学习中注意把握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将移液管里下端残液吹入锥形瓶 | |
| B. | 滴定时向锥形瓶中加入少量的蒸馏水后继续滴定 | |
| C. | 滴定管用蒸馏水洗涤后未用标准碱液润洗就装入标准碱液进行滴定 | |
| D. | 用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com