
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,该电池在使用中石墨I电极上生成氧化物Y,下列说法错误的是

A. Y的化学式可能为NO
B. 石墨I极为负极,石墨Ⅱ极为正极
C. 该电池放电时NO3-从右侧向左侧迁移
D. 石墨I附近发生的反应为NO2+NO3ˉ-eˉ=N2O5
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 . 实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL﹣1、0.001molL﹣1 , 每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL﹣1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL﹣1KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? . (填“行”或“不行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的1,2-二氯乙烷,可采用的方法是( )
A. 乙烯和HCl加成 B. 乙烷和Cl2按1∶2的体积比在光照条件下反应
C. 乙烯和氯气加成 D. 乙烯先与HCl加成,再与等物质的量的氯气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X元素原子的半径最小。Z、W在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层子数的2倍。请回答:
(1)Z2的电子式为___________,YW2的结构式为____________。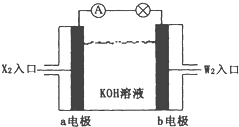
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为__________________。若有16gW2参加反应,转移的电子数是____________。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐_______(化学式),与足量的NaOH溶液在加热条件下反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com