
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
(16分)(1)B(2分)
(2)4FeS+3O2+6H2SO4=2Fe2(SO4)3+ 6H2O +4S(3分,写离子方程式“4FeS+3O2+12H+=4Fe3++6H2O+4S”也得分)
(3)Fe(或铁粉)(2分)
(4)蒸发皿(或烧杯,多答石棉网不扣分)、玻璃棒(2分)
(5)升高温度促进Fe3+的水解(2分),过高温度不利于聚铁的形成(或者完全水解了)(1分) 注:答“温度太低不利于水解,温度过高难于生成聚铁(或意思相近)”也得分
(6)(4分)设铁元素的质量为xg,根据铁、硫元素守恒可得关系式,则:
n Fe ~[Fe(OH)(SO4)]n ~ nBaSO4 (1分)
56n 233n
x 3.495g
56n/233n=x/3.495g(1分)
x=0.84g(1分)
则样品中铁元素的质量分数=0.84/2.700×100%=31.11%(1分)
解析试题分析:(1)SiO2的性质稳定,灼烧时不能反应,而S灼烧时易与O2反应生成SO2气体;二氧化硫具有漂白性,能使品红溶液褪色,故A错误;二氧化硫具有酸性氧化物的通性,易溶于水并与水反应生成亚硫酸,其溶液显酸性,能使紫色石蕊溶液变红,但是不能褪色,故B正确;二氧化硫具有还原性,酸性高锰酸钾具有强氧化性,二者易发生氧化还原反应,因此能使酸性高锰酸钾溶液褪色,故C错误;溴水具有氧化性,能被二氧化硫还原为溴离子,因此SO2能使溴水褪色,故D错误;(2)根据化合价升降情况可治,FeS是还原剂,O2是氧化剂,根据电子得失、电荷、原子守恒原理可得:4FeS+3O2+6H2SO4=2Fe2(SO4)3+ 6H2O +4S或4FeS+3O2+12H+=4Fe3++6H2O+4S;(3)绿矾为七水合硫酸亚铁,由此推断步骤③的目的将Fe3+还原为Fe2+,根据除杂不引入新杂质的原则,应该加入过量的铁屑或铁粉;(4)蒸发浓缩、冷却结晶主要使用的仪器是蒸发皿、烧杯、玻璃棒、酒精灯;(5)铁盐能水解,水解反应是吸热反应,温度过低不利于Fe3+的水解,升高温度可以促进Fe3+的水解,但是温度过高时Fe3+能彻底水解变为沉淀,胶体也会聚沉为沉淀,因此采用70~80℃的条件;(6)设铁元素的质量为xg,根据铁、硫元素守恒可得关系式,则:
n Fe ~[Fe(OH)(SO4)]n ~ nBaSO4
56n 233n
x 3.495g
根据式量之比等于质量之比,则56n/233n=x/3.495g,解得:x=0.84g,所以样品中铁元素的质量分数=0.84/2.700×100%=31.11%。
考点:考查物质制备的工艺流程大题,涉及二氧化硫气体的主要性质、氧化还原反应方程式的配平、混合物的分离与提纯、化学实验基本操作、盐类的水解、胶体的主要性质、物质组成的测定和计算。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:实验题
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是 ;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂 ;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是( )( ) (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是 (填写“游离态”或“化合态”)。解吸后应加入 (填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下列是实验操作与预期实验目的或所得实验结论,正确的填(√)错误的填(×)
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ |  与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性 溶液 溶液 | 检验制得气体是否为乙烯 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0. 88 | 3. 10 | 1. 50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
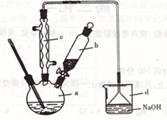
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol ?L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为__________________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是______(填字母)。
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是____________________________,装有碱石灰的干燥管的作用是____________________________。
(4)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________,请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因________________________________________________________。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com