
分析 ①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②根据v=$\frac{△c}{△t}$计算v(NH3),再根据反应速率之比等于系数之比计算v(N2);
③反应是放热反应,升高温度后平衡逆向进行,平衡常数减小;
④根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;
②5min达平衡,△c(NH3)=0.1mol/L,所以v(NH3)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),根据反应速率之比等于系数之比,则v(N2)=$\frac{1}{2}$×0.02mol/(L•min)=0.01mol/(L•min),
故答案为:0.01mol/(L•min);
③该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
④a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;
b.该反应为反应前后体积不等的反应,则容器内压强保持不变,能判断达到平衡,故b正确;
c.υ正(N2)=2υ逆(NH3),正、逆反应速率不等,不能判断平衡,故c错误;
d.混合气体中 c(NH3)不变,为平衡的特征,能判断达到平衡,故d正确;
故选ad.
点评 本题考查较综合,涉及化学反应速率计算、化学平衡常数、化学平衡的判定等,注意化学平衡判定选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每亳升质量为q g,物质的量浓度为c。则溶质的相对分子质量为( )
A. 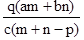 B.
B. 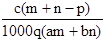 C.
C. 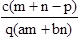 D.
D. 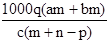
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com