
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g) +4H2O(g) ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ/mol
C.N2H4(g)+ N2O4(g)=
N2O4(g)= N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
短周期元素A、B、C的原子序数之和为37,A、B在同一周期,A+、C-具有相同的核外电子层结构。下列推测不正确的是( )
A. 同周期元素中C的氢化物稳定性最强
B. 同周期元素中A的金属性最强
C. 原子半径:A>B,离子半径:A+>C-
D. A、B、C的简单离子中,会破坏水的电离平衡的是C
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述不正确的是( )
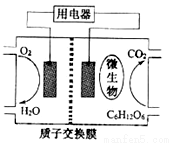
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标
准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:填空题
在一密闭容器中,充入1mol N2 和3 mol H2,并在一定温度和压强条件下,使其发生反应:N2(g) + 3H2 (g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
(1)若保持容器体积不变,再向其中充入1mol N2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是______________________。
(2)若保持容器体积不变,再向其中充入1mol氩气,反应速率会_________(填“加快”、“减慢”或“不变”),理由是_______________________。
(3)若保持容器气体压强不变,再向其中充入1mol N2 和3 mol H2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是____________________。
(4)使用催化剂,反应速率会_________(填“加快”、“减慢”或“不变”),理由是_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g) △H1
C(s)+ 1/2 O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3
S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5
2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7
CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A.①③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
H2(g)+Br2(g)=2HBr(g) ΔH=-akJ/mol则a是
A.404 B.72 C.230 D.200
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。

已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: 。
(2)操作Ⅰ得到的残渣的化学式为 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是
A.4mol·L-1盐酸 B.6mol·L-1硫酸
C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点 。

②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg·L-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
金属镍有广泛的用途粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— Ni
Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com