
分析 (1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
(2)燃料电池中,燃料在负极失电子发生氧化反应,N2H4失电子生成N2,据此分析书写;
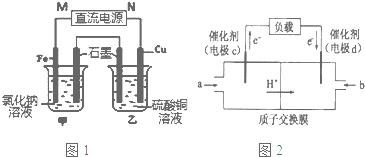
(3)根据通电一段时间后,向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红可知,甲中的石墨极为阴极,则乙中的石墨极为阳极,OH-放电,据此分析pH的变化;本着出来什么就加入什么的原则来分析需要加入的物质;
(4)负极反应式为CH3OH-6e-+H2O=CO2+6H+,正极反应式为O2+4H++4e-=2H2O,按照电极反应式计算.
解答 解:(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热QkJ,则16g甲烷完全燃烧生成二氧化碳和液态水放出的热量为16×QKJ=16QKJ,
则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QKJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QKJ•mol-1.
(2)肼--空气燃料电池是一种碱性电池,该电池放电时,负极是肼燃烧生成氮气和水,负极的电极反应式为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(3)根据通电一段时间后,向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红可知,甲中的石墨极产生了大量的OH-,即为阴极,则乙中的石墨极为阳极,来自于水的OH-放电:2H2O-4e-=4H++O2↑,产生了H+,故溶液的pH变小;乙池中的电解方程式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$4Cu+O2↑+2H2SO4,故从电解槽中出来的有铜和氧气,故可以加入CuO,也可以加入CuCO3:CuCO3+H2SO4=CuSO4+H2O+CO2↑,但不能加入Cu(OH)2或Cu2(OH)2CO3,因为含有H元素,会转化为水,使电解质溶液的浓度降低,不能恢复至原浓度,故选AC,故答案为:变小;AC;
(4)负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻$\frac{1}{6}$×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×$\frac{1}{4}$=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
故答案为:12g.
点评 本题考查较为综合,涉及热化学方程式的书写以及电化学知识,综合考查学生的分析能力和计算能力,把握电极方程式的书写,注意质子交换膜的性质,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:
绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
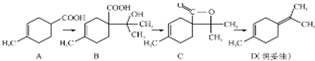 胡妥油(D)用作香料的原料,它可由A合成得到:
胡妥油(D)用作香料的原料,它可由A合成得到:| A. | 按系统命名法有机物A的名称为3-甲基-3-环已烯甲酸 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | C 的分子式为C10H14O2 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
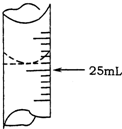 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H20与NH4CI的反应 | ||
| C. | 甲烷在02中的燃烧反应 | D. | 灼热的炭与C02反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g C2H4中含有的极性共价键数为6NA | |
| B. | 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 浓度均为0.1 mol•L-1的C6H5ONa溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 | |
| D. | 常温下,浓度分别为0.1 mol•L-1和0.01 mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com