
| A. | 汽油和水 | B. | 苯和盐酸 | C. | 酒精和水 | D. | 水和四氯化碳 |
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
将4mol A气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若是2min后测得C的浓度为0.6mol/L,现有下列说法,正确的是( )
2C(g)。若是2min后测得C的浓度为0.6mol/L,现有下列说法,正确的是( )
A.物质A表示的反应速率为0.3mol/(L·min)
B.物质B表示的反应速率为0.6mol/(L· min)
C.2min时物质A的转化率为70%
D.2min时物质B的浓度是1.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
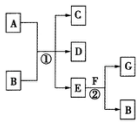 如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:
如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、C1- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在c(OH-)=1×10-13的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
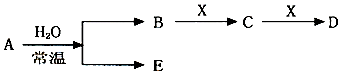
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,化学平衡向右移动 | |
| B. | 温度升高,化学平衡一定会发生移动 | |
| C. | 增大压强,缩小容器体积,化学平衡不移动 | |
| D. | 添加MnO2,化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com