
分析 (1)在常温下,有体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb;
根据该温度下水的离子积计算出氢氧化钠的浓度、硫酸中氢离子浓度,然后根据反应后溶液显示中性计算出两溶液的体积之比;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
②反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离.
解答 解:(1)体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb =10-14+a+b=10-10=10:1;
某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb =10-13+a+b=10-10=1:10;
故答案为:1:10;1:10;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V3<V2,
所以消耗酸的体积关系为:V3>V2=V1,
故答案为:V2>V3=V1;
(3)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,即醋酸用的时间最少,则反应时间a=c>b,
故答案为:a=b=c;a=c>b.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应过程、稀释构成中醋酸都不断电离出氢离子,反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
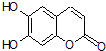 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
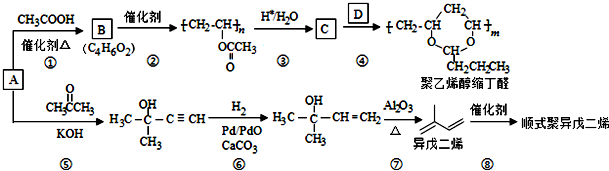
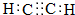 ,B含有的含氧官能团是酯基(写名称).
,B含有的含氧官能团是酯基(写名称).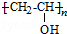 ,D为CH3CH2CH2CHO.
,D为CH3CH2CH2CHO.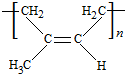 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| B. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 | |
| C. | Cl2不能使有色布条褪色,但Cl2具有氧化性 | |
| D. | 过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与T形成的化合物有两性 | |
| C. | Q、T两元素的氢化物分子间都存在氢键 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
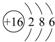
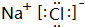 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
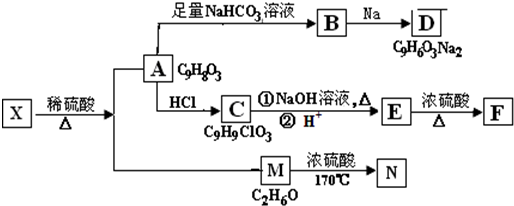
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 最高正价X>Z | B. | 原子半径X>Q | C. | 单质熔点Y>Q | D. | 阴离子还原性Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式:[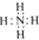 ]+Br- ]+Br- | |
| B. | S2-的结构示意图: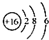 | |
| C. | 原子核内有18个中子的氯分子:${\;}_{17}^{35}$Cl2 | |
| D. | 水分子的形成过程用电子式表示为:H2+ → → |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com