
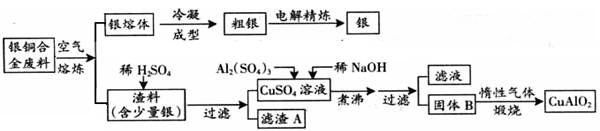
 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写). CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.
CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.蒸发、蒸馏、过滤、萃取 |
| B.过滤、蒸馏、蒸发、萃取 |
| C.过滤、蒸发、蒸馏、分液 |
| D.萃取、蒸馏、蒸发、过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 试剂C | A离子 | B离子 |
| A | HNO3、BaCl2 | SO42- | SO32- |
| B | AgNO3 | Cl- | I- |
| C | KSCN | Fe2+ | Fe3+ |
| D | NH3?H2O | Al3+ | Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5 |
| PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
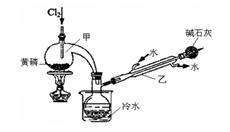
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含NH4+ |
| B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32- |
| C.用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子 |
| D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
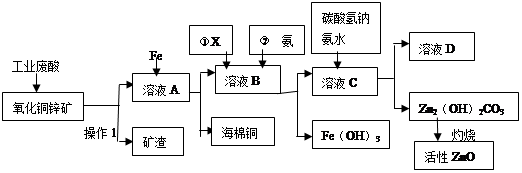
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2(HCl)饱和NaHSO3溶液 | B.Fe(Al) NaOH溶液 |
| C.CO2(CO)灼热CuO | D.Cl2(H2O)碱石灰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu(Fe)——加盐酸,过滤 |
| B.乙醇(水)——加生石灰,蒸馏; |
| C.KNO3溶液(KCl)——降温结晶,过滤; |
| D.CO2(HCl)——饱和NaOH溶液,洗气。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com