
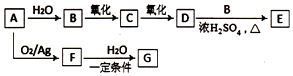
 A��һ����Ҫ�Ļ���ԭ�ϣ�C��F�ķ���ʽ��ΪC2H4O��F��û�в����ͼ��Ļ�״�л��G�ķ���ʽΪC2H6O2��G�к���������ͬ�Ĺ����ţ�ת����ϵ��ͼ��
A��һ����Ҫ�Ļ���ԭ�ϣ�C��F�ķ���ʽ��ΪC2H4O��F��û�в����ͼ��Ļ�״�л��G�ķ���ʽΪC2H6O2��G�к���������ͬ�Ĺ����ţ�ת����ϵ��ͼ�� ��
������ A��һ����Ҫ�Ļ���ԭ�ϣ���ת����ϵ��֪����ˮ��Ӧ����B��������������BΪ������C��֪����2��̼ԭ�ӣ���AΪCH2=CH2��BΪCH3CH2OH��CΪCH3CHO��DΪCH3COOH�����Ҵ���Ӧ����EΪCH3COOCH2CH3��G�ķ���ʽΪC2H6O2��G�к���������ͬ�Ĺ����ţ�ӦΪCH2OHCH2OH����FΪ ���Դ˽����⣮
���Դ˽����⣮
��� �⣺��1��CΪCH3CHO�����еĹ�����Ϊȩ�����ʴ�Ϊ��ȩ����
��2�������Ϸ�����֪EΪCH3COOCH2CH3���ʴ�Ϊ��CH3COOCH2CH3��
��3��FΪ ����һ����������ˮ��Ӧ�����Ҷ���������ʽΪ
����һ����������ˮ��Ӧ�����Ҷ���������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4��A��DΪCH3COOH���������ԣ���ʹʯ����Һ��죬��A��ȷ��
B���Ҵ������������ͭ����Һ����Ӧ���������������ͭ�����кͷ�Ӧ����ȩ��������ͭ����������ԭ��Ӧ���ɼ��𣬹�B����
C���Ҵ���дΪC2H4•H2O��������ʵ�����A��B�ֱ���ȫȼ����������������ȣ���C��ȷ��
D���������������ڱ���̼������Һ���Ҵ�������ˮ��������̼���Ʒ�Ӧ�����ñ���̼������Һ���ӣ���D��ȷ��
�ʴ�Ϊ��ACD��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ���ķ���������ע����AΪͻ�ƿڽ�������Ϣ�����ƶϣ���Ϥ�����л���ṹ��ʽ�������ż������ʹ�ϵ����Ŀ�ѶȲ���


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��ʼ����pH | ������ȫpH |
| Fe��OH��3 | 2.2 | 3.2 |
| Cu��OH��2 | 5.6 | 6.7 |
| Al��OH��3 | 3.7 | 4.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| �հ�ʵ���������������Һ�������mL�� | 0.75 | 0.50 | 0.80 |
| 0.25g��Ʒ�������������Һ�������mL�� | 24.75 | 24.85 | 24.80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ͼ��ĤΪ��Ĥ��ֻ����������ͨ������OH-��������ͨ����Ĥ | |
| B�� | ���ʱ�������缫��ӦʽΪ��2H++2e-�TH2�� | |
| C�� | ���ʱ������3mol����ͨ�����ߣ���һ������0.6mol KIO3 | |
| D�� | ����ܷ�ӦΪ��KI+3H2O $\frac{\underline{\;���\;}}{\;}$KIO3+3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������������ʹƷ����Һ��ɫ | |
| B�� | Ư�۱�¶�ڿ����о��û���� | |
| C�� | �ڼ��������£�þ���ڶ�����̼������ȼ�� | |
| D�� | ��ˮ��������Ư�ס�ɱ�����������õ��������к��е�Cl2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֬������Ȼ�߷��ӻ�����ڼ���������ˮ����Ƶ÷��� | |
| B�� | ��һ�������£�������֮���ܷ�����Ӧ�ϳɶ��� | |
| C�� | �ڵ���ˮ��Һ�м����������ƣ��ټ����ˮ����Һδ������˵�����ۼ���ȫˮ�� | |
| D�� | ��������Һ�м���Na2SO4Ũ��Һ�й�����������������ˮ����岻�ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ļ�ѧ�����ȶ� | |
| B�� | ���ڳ���ʱ����������Ӧ | |
| C�� | �����н����ԣ�Ҳ���зǽ����� | |
| D�� | ����������Ӧ����һ�����ܵ������ﱡĤ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2 | B�� | HCl | C�� | SO2 | D�� | NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ���м��е⣬������ɵ���Һ�����۱��� | |
| B�� | ����������ʳ�ôס�����ˮ����������������Һ��pH������ | |
| C�� | ʹ����������ˮ����ʱ��������������ˮ�е��л��ﷴӦ�����ɵ��л��Ȼ�����ܶ����к� | |
| D�� | �轺����ʯ�ҡ��Ȼ��Ƶȶ���ʳƷ��װ���г��õĸ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

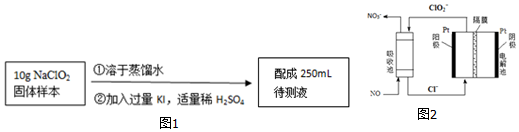
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com