
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
【答案】![]() 2MnO
2MnO![]() +16H++10Cl
+16H++10Cl![]() =2Mn2++5Cl2↑+8H2O KMnO4 >Cl2> H2SO4 ab
=2Mn2++5Cl2↑+8H2O KMnO4 >Cl2> H2SO4 ab
【解析】
(1)根据氧化还原反应中元素化合价升降及得失电子数目进行分析;
(2)根据离子反应方程式的书写原则进行书写;
(3)根据氧化还原反应中氧化剂的氧化性强于氧化产物进行判断;
(4)根据HCl中Cl元素化合价部分升高,部分不变进行分析。
(1)该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,所以Cl2是氧化剂、SO2是还原剂,其转移电子数是2,单线桥转移电子数目和方向为![]() ;
;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中KMnO4、KCl、MnCl2均为可溶性盐必须拆成离子,HCl为强电解质,也拆成离子,故反应的离子方程式为2MnO![]() +16H++10Cl
+16H++10Cl![]() =2Mn2++5Cl2↑+8H2O;
=2Mn2++5Cl2↑+8H2O;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中KMnO4做氧化剂,氧化HCl得到氧化产物Cl2,氧化性KMnO4>Cl2;
反应2H2O+Cl2+SO2=H2SO4+2HCl中Cl2做氧化剂,氧化SO2得到氧化产物H2SO4,氧化性Cl2>H2SO4;
故Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为KMnO4 >Cl2> H2SO4;
(4)反应②中HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,盐酸中的Cl有部分转化为化合价不变的氯化钾中去,也体现了盐酸的酸性,答案选ab。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量在数值上相等
B.6.02×1023个N2和6.02×1023个O2的质量比等于7︰8
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关化学用语表述正确的是( )
A. NH4Cl的电子式: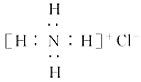
B. C原子的轨道表示式: ![]()
C. 冰醋酸为共价化合物,受热熔融:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. Fe2+基态核外电子排布式为1s22s22p63s23p63d6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
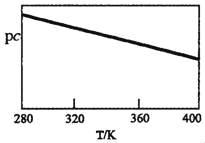
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
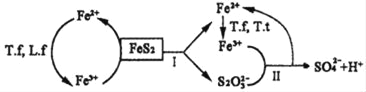
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L乙醇中含有的氧原子数目为0.1NA
B.1 L 1mol/L的NaHCO3溶液中Na+、H+和CO32-的数目均为NA
C.16 g的O2和O3混合气体中所含原子总数为NA
D.18 g水中所含电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。

下列说法不正确的是( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不列离子方程式书写正确的是
A. 铜片与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO2↑+4H2O
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C. 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 用浓氢氧化钠溶液检验溶液中的NH4+:NH4++OH-![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com