
分析 酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,根据c(H+)水=c(OH-)水,结合Kw的公式计算.
解答 解:酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,
①0.01mol•L-1 的盐酸中c(H+)=0.01mol•L-1,c(H+)水=c(OH-)水=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
②pH=2的醋酸 中c(H+)=0.01mol•L-1,c(H+)水=c(OH-)水=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
③pH=12的氨水中c(OH-)=0.01mol•L-1,c(H+)水=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
④0.01mol•L-1 的NaOH溶液中c(OH-)=0.01mol•L-1,c(H+)水═$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
则由水电离出的c(H+)大小关系①=②=③=④,
故答案为:①=②=③=④.
点评 本题考查溶液中水电离的氢离子浓度的计算,注意把握酸或碱如何影响水电离、以及溶液中氢离子浓度的计算方法是解本题关键,酸中水电离出的c(H+)和碱中水电离出的c(OH-)的计算是学习难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 K2SO4溶液中含有0.6NA个K+和0.3 mol的SO42- | |
| B. | 在标准状况下H2O的摩尔体积约是22.4 L•mol-1 | |
| C. | 将58.5g的NaCl固体溶解在1L的水中,所得的溶液物质的量浓度为1mol/L | |
| D. | 1 mol任何气体在标准状况下的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
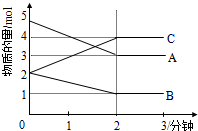 (1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
(1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

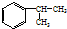 ,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是
,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是 (写结构简式).
(写结构简式). +nHCHO$→_{△}^{催化剂}$
+nHCHO$→_{△}^{催化剂}$ +nH2O.
+nH2O. G:
G: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
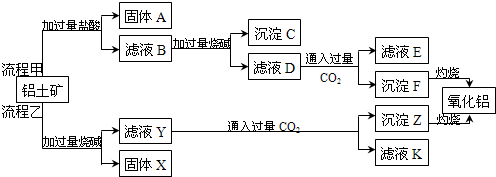
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 C2H5(g)?
C2H5(g)?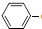 CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com