
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.02molL﹣1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液 | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
① | 20.00 | 0.00 | 21.18 |
② | 20.00 | 1.02 | 21.00 |
③ | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需 .
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点时,读数时俯视
D.滴定时锥形瓶中有液体溅出
E.一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
【答案】
(1)胶头滴管、500mL容量瓶
(2)酸式
(3)A,E
(4)0.08
【解析】解:(1)粗略配制高锰酸钾溶液,先计算所需高锰酸钾质量,在烧杯中溶解,用玻璃棒搅拌溶解得到溶液,然后在500mL容量瓶中配制,所以需要的玻璃仪器为除烧杯、玻璃棒之外还需要胶头滴管、500mL容量瓶,
所以答案是:胶头滴管、500mL容量瓶;
(2)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,不能装在碱式滴定管中,应装在酸式滴定管中;高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为紫红色,红色30s内不褪去,说明滴定到终点,
所以答案是:酸式;加入最后一滴KMnO4溶液,溶液变为紫红色,且30s内红色不褪去;
(3)A、滴定管滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故A正确;
分析,可知c(待测)偏大,故A正确;
B、锥形瓶洗涤后没有干燥,待测液的物质的量不变,标准液的体积不变,结果不变,故B错误;
C、滴定终点时,读数时俯视,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故C错误;
分析,可知c(待测)偏小,故C错误;
D、滴定时锥形瓶中有液体溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故D错误;
分析,可知c(待测)偏小,故D错误;
E、一滴高锰酸钾溶液附在锥形瓶壁上未冲下,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故E正确;
分析,可知c(待测)偏大,故E正确;
所以答案是:AE.
(4)三次消耗高锰酸钾溶液的体积分别为:21.18mL、19.98mL、20.02mL,第一组误差较大,舍去,两次溶液的平均体积为20.00mL,
5C2O42﹣~ | 2MnO4﹣ |
5 | 2 |
0.02molL﹣1×20.00mL | C(KMnO4)×20.00mL |
解得:C(KMnO4)=0.08molL﹣1
所以答案是:0.08.
【考点精析】本题主要考查了酸碱中和滴定的相关知识点,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能正确解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
A. 沉淀中OH-的质量为(n-m)g
B. 恰好溶解后溶液中的NO的物质的量为aVmol
C. 反应过程中转移的电子的物质的量为![]() mol
mol
D. 与合金反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中的成盐元素除了氯之外,还有溴和碘。
(1)工业上可用Cl2和NH4Cl溶液反应制取NCl3(NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理)。当用干燥洁净的玻璃棒蘸取NCl3滴到干燥的红色石蕊试纸上,试纸不褪色;若取NCl3滴入50-60oC热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。写出对应该现象的化学方程式:____________________________________________________。
(2)①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:______KIO3+ ______KI + H2SO4 = ______K2SO4+_____I2+ ______
②上述反应生成的I2可用四氯化碳检验,现象为________________________________________。
(3)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量物的/mol | 0.5 | 1.3 | x |
则x= ______;原溶液中NaI的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L 盐酸生成沉淀.已知:Ksp(AgCl)=1.8×10﹣10 , 则生成沉淀后的体系中c(Ag+)为( )
A.1.8×10﹣7mol/L
B.1.8×10﹣8 mol/L
C.1.8×10﹣9mol/L
D.1.8×10﹣10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 将钠块投入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B. 向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D. 用小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2氯丙烷制取少量的1,2丙二醇经过下列哪几步反应( )
A. 加成→消去→取代 B. 消去→加成→水解
C. 取代→消去→加成 D. 消去→水解→加成消
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436 | 243 | 431 |
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
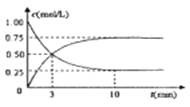
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转换率α(H2)=___________。
②若反应CO2+3H2![]() CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________(填字母)。
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:
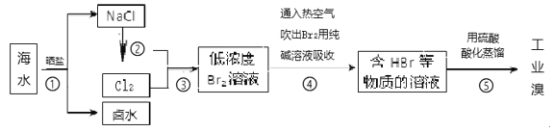
①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是( )
A.由图①所示实验可得出三种元素的非金属性强弱顺序是:氯>碳>硅
B.图②可用于干燥、收集氯化氢,并吸收多余的氯化氢
C.图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的△H>0
D.对反应:A(s)+2B(g)xC(g),根据图④可以求出x=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com