
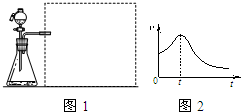
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
 ;
; ,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒、⑦秒表,
,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒、⑦秒表,

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、定温定容充入少量NO2 |
| B、升高温度 |
| C、定温定容充入少量N2O4 |
| D、增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 溶解度( g/100g水) |
| 氯化钠 | 36 |
| 硝酸钾 | 32 |
| 硝酸钠 | 87 |
| 氯化钾 | 37 |
| A、食盐不溶解 |
| B、食盐溶解,无晶体析出 |
| C、食盐溶解,析出2 g硝酸钾晶体 |
| D、食盐溶解,析出2 g氯化钾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液:Na+、Al3+、Cl-、AlO2- |
| B、pH=1的溶液:Na+、NH4+、Cu2+、NO3- |
| C、与铝反应产生大量氢气的溶液:Na+、K+、Cl-、AlO2- |
| D、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
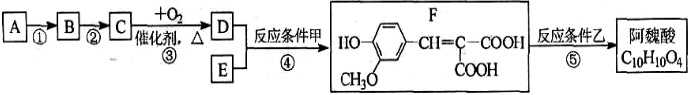
| 反应条件甲 |
| 反应条件乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
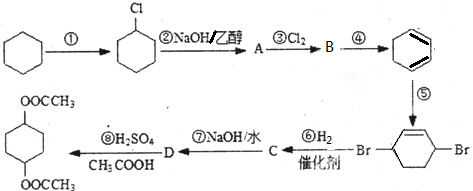
查看答案和解析>>
科目:高中化学 来源: 题型:
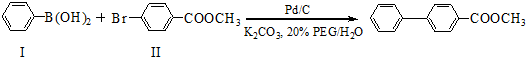

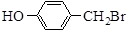 ,则Ⅷ的核磁共振氢谱峰面积比为
,则Ⅷ的核磁共振氢谱峰面积比为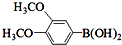 与化合物
与化合物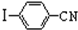 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com