
ЯТСаРызгЗНГЬЪНжаЃЌБэДяе§ШЗЕФЪЧЃЈ ЃЉ
AЃЎЯђ NaHS ШмвКжаЭЈШыЪЪСПТШЦјЃКHS+Cl2 =SЁ§+HЃЋ+2Cl
BЃЎЯђFe(OH)3аќзЧвКжаМгШыЧтЕтЫсЃКFe(OH)3+3HЃЋ=Fe3ЃЋ+3H2O
CЃЎНЋ 10 mL 0.1 mol•LЃl HClШмвКгы20 mL 0.05 mol•LЃl Na3PO4 ШмвКЛьКЯ
3HЃЋ+2 PO43= H2PO4+HPO42
DЃЎЯђ Mg(HCO3)2ШмвКжаМгШыЙ§СПNaOH ШмвК:
Mg2ЃЋ+2HCO3+2OH=MgCO3Ё§+CO32+2H2O
 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| Рызг | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| ХЈЖШЃЈmol/LЃЉ | a | 0.05 | 0.10 | 0.50 | 0.58 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| ЛЏбЇЪН | ЕчРыГЃЪ§ |
| HClO | K=3ЁС10-8 |
| H2CO3 | K1=3ЁС10-3 |
| K2=3ЁС10-11 |
| AЁЂЯђNa2CO3ШмвКжаЕЮМгЩйСПТШЫЎЃКCO32-+2Cl2+H2O=2Cl-+2HClO+CO2 |
| BЁЂЯђNaHCO3ШмвКжаЕЮМгЩйСПТШЫЎЃК2HCO3-+CI2=CI-+CIO-+2CO2+H2O |
| CЁЂЯђNaClOШмвКжаЭЈШыЩйСПCO2ЃКCO2+NaClO+H2O=NaHCO3+HClO |
| DЁЂЯђNaClOШмвКЭЈШызуСПCO2ЃКCO2+2NaClO+H2O=Na2CO3+2HClO |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
ЁОЙцИёЁП УПЦЌКЌчњчъЫсбЧЬњ ЁОЪЪгІжЂЁП гУгкШБЬњадЦЖбЊжЂЃЌдЄЗРМАжЮСЦгУ ЁОгУСПгУЗЈЁП ГЩШЫдЄЗРСП ЁОжќВиЁП БмЙтЁЂУмЗтЁЂдкИЩдяДІБЃДц |
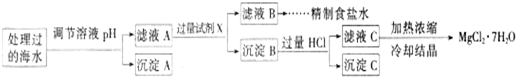
(1)ИУвЉЦЗжаFe2+ЛсЛКТ§бѕЛЏЁЃЙњМвЙцЖЈИУвЉЮяжаFe2+ЕФбѕЛЏТЪГЌЙ§10.00%МДВЛФмдйЗўгУЁЃ
ЂйЮЊСЫМьбщФГвЉЕъГіЪлЕФЁАЫйСІЗЦЁБЪЧЗёбѕЛЏЃЌЪЕбщЪвгІбЁгУЕФМьбщЪдМСЮЊ__________(ЬюЪдМСЕФУћГЦ)ЃЛ
ЂкЪЕбщЪвПЩВЩгУH2SO4ЫсЛЏЕФKMnO4ШмвКЃЌЖдЁАЫйСІЗЦЁБжаЕФFe2+НјааЕЮЖЈ(МйЩшвЉЦЗжаЃЌЦфЫћГЩЗжВЛгыKMnO4ЗДгІ)ЁЃЧыХфЦНЯТСаРызгЗНГЬЪНЁЃ
__________![]() +__________Fe2++__________H+
+__________Fe2++__________H+![]() __________Mn2++__________Fe3++__________H2O
__________Mn2++__________Fe3++__________H2O
ЂлГЦСПЩЯЪіКЌЬњдЊЫижЪСПЗжЪ§ЮЊ20.00%ЕФЁАЫйСІЗЦЁБ
(2)вбжЊчњчъЫсбЧЬњЯрЖдЗжзгжЪСПЮЊ172ЃЌчњчъЫсЮЊгаЛњЫсЁЃКЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2013-2014бЇФъЩЯКЃЪаГчУїЯиИпШ§ЩЯбЇЦкЦкФЉЃЈвЛФЃЃЉПМЪдЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКЬюПеЬт
ВПЗжШѕЫсЕФЕчРыЦНКтГЃЪ§ШчЯТБэЃК
|
ШѕЫс |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
ЕчРыЦНКтГЃЪ§ ЃЈ25ЁцЃЉ |
|
|
|
|
ЃЈ1ЃЉдкЮТЖШЯрЭЌЪБЃЌИїШѕЫсЕФKiжЕгыЫсадЕФЯрЖдЧПШѕЕФЙиЯЕЮЊЃК________________________ЁЃ
ЃЈ2ЃЉЯТСаРызгЗНГЬЪНе§ШЗЕФЪЧ
AЃЎ2ClOЃ + H2O + CO2 Ёњ 2HClO + CO32Ѓ
BЃЎ2HCOOH + CO32Ѓ Ёњ 2HCOOЃ + H2O + CO2Ёќ
CЃЎH2SO3 + 2HCOOЃ Ёњ 2HCOOH + SO32Ѓ
DЃЎCl2 + H2O+2CO32Ѓ Ёњ 2HCO3Ѓ + ClЃ + ClOЃ
ЃЈ3ЃЉГЃЮТЯТЃЌpH=3ЕФHCOOHШмвКгыpH=11ЕФNaOHШмвКЕШЬхЛ§ЛьКЯКѓЃЌШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЃ
бЧЮјЫс(H2SeO3)вВЪЧвЛжжЖўдЊШѕЫсЃЌГЃЮТЯТЪЧвЛжжЮоЩЋЙЬЬхЃЌвзШмгкЫЎЃЌгаНЯЧПЕФбѕЛЏадЁЃ
ЃЈ4ЃЉЭљбЧЮјЫсШмвКжаВЛЖЯЭЈШыSO2 ЛсВњЩњКьКжЩЋЕЅжЪЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃКЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЃ
ЃЈ5ЃЉНЋбЧЮјЫсгы30%ЕФH2O2МгШШПЩжЦЕУЮјЫс(H2SeO4)ЃЌЗДгІЗНГЬЪНШчЯТЃК
H2SeO3 + H2O2 Ёњ H2SeO4+H2OЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧЁЁЁЁЁЁЁЁЁЁЁЁЁЃЈЁЁЁЁЃЉ
AЃЎH2O2МШЪЧбѕЛЏМСгжЪЧЛЙдМС
BЃЎH2O МШВЛЪЧбѕЛЏВњЮягжВЛЪЧЛЙдВњЮя
CЃЎH2SeO4МШЪЧбѕЛЏВњЮягжЪЧЛЙдВњЮя
DЃЎбѕЛЏадЃКH2SeO3ЃОH2SeO4
экЫсЃЈH6TeO6ЃЉЪЧвЛжжКмШѕЕФЫсЃЌ ЃЌЕЋЫќЕФбѕЛЏадБШСђЫсЛЙвЊЧПЁЃдкЫсадНщжЪжаЃЌэкЫсПЩНЋHIбѕЛЏГЩI2ЃЌЗНГЬЪНШчЯТЃК
ЃЌЕЋЫќЕФбѕЛЏадБШСђЫсЛЙвЊЧПЁЃдкЫсадНщжЪжаЃЌэкЫсПЩНЋHIбѕЛЏГЩI2ЃЌЗНГЬЪНШчЯТЃК
ЁЁЁЁ ЁЁHI+ЁЁЁЁ ЁЁH6TeO6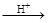 ЁЁЁЁ ЁЁTeO2+ЁЁ ЁЁЁЁTe+ЁЁЁЁ ЁЁI2+ЁЁ ЁЁЁЁH2O
ЁЁЁЁ ЁЁTeO2+ЁЁ ЁЁЁЁTe+ЁЁЁЁ ЁЁI2+ЁЁ ЁЁЁЁH2O
ЃЈ6ЃЉШєЗДгІжаЩњГЩЕФTeO2гыTeЕФЮяжЪЕФСПжЎБШЮЊ ЃЌЪдХфЦНЩЯЪіЛЏбЇЗНГЬЪНЁЃ
ЃЌЪдХфЦНЩЯЪіЛЏбЇЗНГЬЪНЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2012-2013бЇФъЩТЮїЪЁЮїАВЪаИпШ§ЕквЛДЮжЪМьЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСаРызгЗНГЬЪНе§ШЗЕФЪЧ
AЃЎгУЧтбѕЛЏФЦШмвКГ§ШЅТСЦЌБэЖјЩЯЕФбѕЛЏФЄЃКAl3ЃЋЃЋ4OHЃ=AlO2ЃЃЋ2H2O
BЃЎдкКЌ3ЃЎ2amolHNO3ЕФЯЁШмвКжаЃЌМгШыamolЬњЗлЃК5FeЃЋ4NO3ЃЃЋ16HЃЋ=3Fe2ЃЋЃЋ2Fe3ЃЋЃЋ4NOЁќЃЋ8H2O
CЃЎГЮЧхЪЏЛвЫЎгыЙ§СПЕФаЁЫеДђШмвКЗДгІЃКCa2ЃЋЃЋOHЃЃЋHCO3Ѓ=CaCO3Ё§ЃЋH2O
DЃЎЙ§бѕЛЏЧтФмЪЙЫсадKMnO4ШмвКЭЪЩЋЃК3H2O2+2MnO4-+6H+=2Mn2++4O2Ёќ+6H2O
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com