
����Ŀ���밴Ҫ�ش��������⣺
��1����ͬ���ʵ�����SO2��SO3������O������֮��Ϊ________��
��2����״���£�4.48 L ��NH3�У�����H����ĿԼΪ________��
��3����״���£�1 mol H2O��11.2 L CH 4��8 g O2�У������С����________��
��4��ij���������Ϊ3.4 g������6.02��1022�����ӣ���������Ħ������Ϊ________��
��5��10 mL 0.5 mol��L-1 Al (NO3)3 ��Һ��NO3�������ʵ���Ũ��Ϊ________��
��6����״���£�89.6 L HCl ��������1 Lˮ���� = 1 g��mL-1���У�����������ܶ�Ϊ1.146 g��mL-1�������������ʵ���Ũ��Ϊ________��
���𰸡�2��3 3.612��1023 1 mol H2O 34 g��mol-1 1.5 mol��L-1 4 mol��L-1
��������
��1�����ʵ���֮�ȵ��ڷ�����Ŀ֮�ȣ������÷��ӵĹ�������������O�����ʵ���֮�ȣ������õ�������֮�ȣ�
��2������ n = ![]() =
= ![]() ��������ʵĹ��ɼ�����
��������ʵĹ��ɼ�����
��3����״���£�ˮΪҺ�壬CH4��O2Ϊ���壬��������״̬���������
��4������n = ![]() �����������ʵ������ٸ���M =
�����������ʵ������ٸ���M = ![]() ���������Ħ��������
���������Ħ��������
��5��ͬһ��Һ�У�����Al (NO3)3��ȫ��������Ӹ���֮�ȵ�����Ӧ�����ʵ���Ũ��֮�ȣ�
��6������n= ![]() ����HCl�����ʵ���������m = nM����HCl�����������mˮ =��Vˮ����ˮ��������������ͨ��V =
����HCl�����ʵ���������m = nM����HCl�����������mˮ =��Vˮ����ˮ��������������ͨ��V = ![]() �����Һ�������������c =
�����Һ�������������c = ![]() �����������ʵ���Ũ�ȣ��ó����ۣ�
�����������ʵ���Ũ�ȣ��ó����ۣ�
��1����SO2��SO3�����ʵ�����ͬ�����Ϊ1 mol�����������������ԭ�ӵ����ʵ���֮��Ϊ2:3����ԭ��Ħ������Ϊ16 g/mol��������O������֮��Ϊ2��3��
�ʴ�Ϊ��2:3��
��2��n(NH3)=![]() = 0.2 mol����N(H)= 3 N(NH3) = 3��0.2mol��NA/mol = 0.6 NA = 3.612��1023��
= 0.2 mol����N(H)= 3 N(NH3) = 3��0.2mol��NA/mol = 0.6 NA = 3.612��1023��
�ʴ�Ϊ��3.612��1023��
��3�����������Ϊ���壬ˮΪҺ�壬1molˮ������Ϊ18g��ˮ���ܶ�ԼΪ1 g/cm3�������Ϊ18 mL��8 g O2��ռ���ΪV(O2) = ![]() = 5.6 L���Ա��������ʣ�ˮ��ռ�����С��
= 5.6 L���Ա��������ʣ�ˮ��ռ�����С��
�ʴ�Ϊ��1 mol H2O��
��4���������ʵ���Ϊn = ![]() =
= ![]() = 0.1mol��������Ħ������ΪM =
= 0.1mol��������Ħ������ΪM = ![]() =
= ![]() = 34 g/mol��
= 34 g/mol��
�ʴ�Ϊ��34 g/mol��
��5������Һ������ΪAl (NO3)3 ��Һ�������ʵ���Ũ��Ϊ0.5 mol��L-1����Al(NO3)3��ȫ���룬���뷽��ʽΪ��Al(NO3)3 = Al3++ 3NO3-�����������ͬ����c(NO3-) = 3![]() 0.5 mol��L-1 = 1.5 mol��L-1
0.5 mol��L-1 = 1.5 mol��L-1
��6�������89.6 L HCl�����ʵ���Ϊ��n(HCl) = ![]() = 4 mol��m(HCl) = 4mol��36.5g/mol=146 g��
= 4 mol��m(HCl) = 4mol��36.5g/mol=146 g��
��Һ����Ϊ��146g+1000mL��1g/mL=1146g��
����Һ�����Ϊ�� ![]() = 1000 mL= 1L��
= 1000 mL= 1L��
���Ը���������ʵ���Ũ��Ϊ��c(HCl) = ![]() = 4 mol/L��
= 4 mol/L��
�ʴ�Ϊ��4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�й��������ӵļ�Ҫ����ͼ������������ȷ���ǣ�������
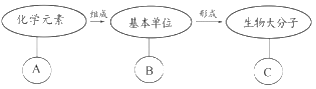
A. ��BΪ�����ǣ���C�ڶ���ϸ���п���Ϊ����
B. ��CΪRNA����BΪ���Ǻ����ᣬAΪC��H��O��N
C. ��C������Ϣ���ݡ����䡢���ȹ��ܣ���B����Ϊ������
D. ��BΪ���Ǻ����ᣬ��C���ܴ����������塢Ҷ���塢Ⱦɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��a��b��c��d��Ϊʯī�缫��ͨ����е�⡣����˵����ȷ���ǣ� ��
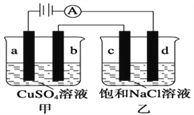
A. ���ձ���d�ĵ缫��ӦΪ 2Cl�C�C2e�C =Cl2��
B. a��c����������������ʵ������
C. ���ձ��з����ķ�ӦΪ2NaCl + 2H2O![]() 2NaOH + H2��+ Cl2��
2NaOH + H2��+ Cl2��
D. �ס������ձ�����Һ��pH�����ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �����ȷ�Ӧ���Ļ�ѧ����ʽΪ2Al��Fe2O3![]() Al2O3��2Fe��ijͬѧ�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ������
Al2O3��2Fe��ijͬѧ�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ������
���ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | ���� |
��1����ͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������Ʋ���һ���ĵ�����������____________________________________________________________��
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________�����۲쵽________ʱ��˵���������к��н�������
��3��ʵ�����ܽ����������ѡ�������Լ��е�____������ĸ����
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
II. ��֪����Na2SO3�����ֽ⡣ʵ�����̺ͽ�����£�
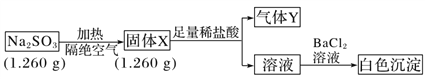
����Y��һ�ִ�����ڱ�״���µ��ܶ�Ϊ1.518 g��L��1����ش�
��4������Y���ӵĵ���ʽ______________����ɫ�����Ļ�ѧʽ______________��
��5����������Na2SO3���ȷֽ�Ļ�ѧ����ʽ____________________________________��
��6����ȡ����X������Na2SO3��ϣ���ˮ�ܽ����ϡ���ᷴӦ���е���ɫ����������д����������ɫ���������ӷ���ʽ__________________________ (�����ǿ�����Ӱ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
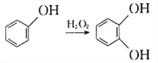
����Ŀ��������H��һ�ֿ�����ҩ���ʵ���������÷�����A�Ʊ�H����������ͼ��ʾ(���ַ�Ӧ��������ȥ)��
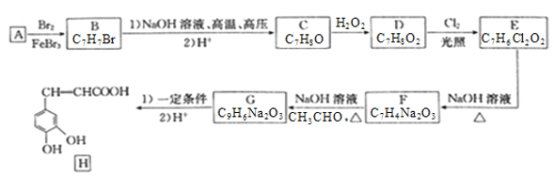
��֪�����л���B������ֻ�����ֲ�ͬ��������ԭ�ӣ�
�������ǻ�����ͬһ̼�ϲ��ȶ�������ˮ�γ��ʻ���ȩ����
��![]() ��
��
�� ��
��
(1)�л���B������Ϊ___________________��
(2)��D����E�ķ�Ӧ����Ϊ__________________��E�й����ŵ�����Ϊ__________________��
(3)��G����H����ġ�һ��������Ϊ____________________��
(4)д��B��NaOH��Һ�ڸ��¸�ѹ�·�Ӧ�Ļ�ѧ����ʽ��___________________________��
(5)F�ữ��ɵ�K��X��K��ͬ���칹�壬X�ܷ���������Ӧ������˴Ź���������ʾ��3�ֲ�ͬ��ѧ�������⣬�������Ϊ1��1��1��д��2�ַ���������X�Ľṹ��ʽ��___________________��
(6)�����![]() �ͱ�ȩ�ϳ�
�ͱ�ȩ�ϳ�![]() ������ͼ��_______________________ (�����Լ���ѡ)��
������ͼ��_______________________ (�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.6mol/LNaCl��Һ��1mol/LCaCl2��Һ��c ��Cl����֮��Ϊ��������
A.2��5
B.3��10
C.1��2
D.3��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Һ��Ӧʱ��Һ��pH�仯��ͼ��ʾ������˵������ȷ����
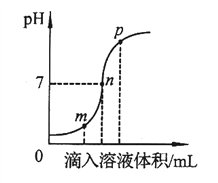
A. m����ʾ����Һ������
B. n����ʾ����Һ�еμӷ�̪��Һ���
C. p����ʾ����Һ������ΪNaCl��NaOH
D. ��ͼ����Ӧ�IJ����ǽ�����������Һ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ���ܱ������У��øߴ�������Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2 H2O(g)![]() 2 H2(g) + O2(g) H>0��ʵ���÷�Ӧ��ϵ��ˮ����Ũ�ȣ�mol/L���ı仯������£�
2 H2(g) + O2(g) H>0��ʵ���÷�Ӧ��ϵ��ˮ����Ũ�ȣ�mol/L���ı仯������£�
��� | ʱ��/min | 0 | 10 | 20 | 30 | 40 | 60 |
�� | �¶�T1 / 1��Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | �¶�T1 / 2��Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
�� | �¶�T2 / 2��Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
����˵������ȷ����
A. ʵ���ǰ20 min��ƽ����Ӧ����v(O2) = 7��10��5 mol/( L��min)
B. ʵ������������µ�ƽ�ⳣ����ȣ���С��ʵ��������µ�ƽ�ⳣ��
C. 2��Cu2O�Ĵ�Ч�ʱ�1��Cu2O�Ĵ�Ч�ʸ�
D. ʵ��ʱ���¶�T2����T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨп�̵��Ͳ��������Ҫ�ɷ�ΪMnO2��NH4Cl��ZnCl2�ȡ�ij�о�С��̽�����ڵ���ڵĺ�ɫ���岢��������ʱ��������ͼ��ʾʵ�顣�����й�ʵ���������ȷ����

A. �������в�������������ת�ƹ��� B. ������Ϊ�������õ�����Һ�Լ���
C. ��������ʢ��ҩƷ������������ D. ��������Ŀ���dz�ȥ�����е�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com