
| A. | 用浓氨水和氢氧化钠制取氨气 | |
| B. | 加热蒸干AlCl3溶液不能得到无水AlCl3 | |
| C. | 工业上SO2和O2在常压下生成SO3 | |
| D. | 水中的c(H+)比0.1mol/LNaOH溶液中的c(H+)大 |
分析 平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A.NH3+H2O?NH3•H2O?NH4++OH-,加入氢氧化钠,增大氢氧根离子浓度,平衡逆向移动,有利于氨气的生成,故能用勒夏特列原理解释,故A不选;
B.AlCl3水解存在平衡AlCl3+3H2O?Al(OH)3(胶体)+3HCl,加热HCl挥发,水解彻底进行,生成Al(OH)3沉淀,灼烧Al(OH)3得Al2O3,能用勒夏特列原理解释,故B不选;
C.2SO2+O2?2SO3,增大压强,平衡正向移动,常压下不利于生成SO3,故不能用勒夏特列原理解释,故C选;
D.水中存在电离平衡:H2O?H++OH-,加入氢氧化钠,增大氢氧根离子浓度,平衡逆向移动,氢离子浓度减小,故能利用平衡移动原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理内涵及适用范围是解本题关键,注意:平衡移动原理只适用于“改变条件时能引起平衡移动的化学反应”,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的燃烧过程均是放热的 | |
| B. | 需要点燃才能发生的燃烧过程是吸热的 | |
| C. | 所有燃料在燃烧过程中均会发生化学键的断裂 | |
| D. | 燃烧后产物的总能量一定小于反应物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
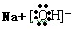 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键; 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向沸水中滴加饱和氯化铁溶液制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | ①②③④ | D. | 只有①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com