
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
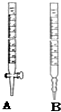 某工厂废水中含游离态氯,通过下列实验测定其浓度
某工厂废水中含游离态氯,通过下列实验测定其浓度查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁和稀硝酸反应 | B. | 氢氧化钡和稀盐酸反应 | ||
| C. | 氢氧化钾溶液中通入硫化氢气体 | D. | 氢氧化钡溶液和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,反应速率加快,平衡常数也会随之变化 | |
| B. | 增加D的量,化学平衡逆向移动 | |
| C. | 增加A的量,B的转化率提高 | |
| D. | 平衡常数的表达式为K=$\frac{c(C)•c(D)}{c(A)^{2}•c(B)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com