
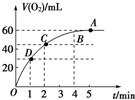
 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.分析 (1)反应方程式为:2H2O2$\frac{\underline{MnO_2}}{△}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)反应放出气体体积为气体总体积的$\frac{3}{4}$时,生成的气体体积为45mL,根据图象判断反应时间;
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(5)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;
(6)在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度.
解答 解:(1)由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60ml;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)生成的总体积为60mL,反应放出气体体积为气体总体积的$\frac{3}{4}$时,生成的氧气体积为45mL,需要的时间为2min,
故答案为:2min;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(5)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小;
(6)由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=$\frac{2mol×0.06L}{22.4L}$=0.00536mol,所以c(H2O2)=$\frac{0.00536mol}{0.05L}$=0.11 mol•L-1,
故答案为:0.11 mol•L-1.
点评 本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,正确分析图象的曲线变化是解答本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用农药化肥,减少病虫害,提高粮食产量 | |
| B. | 开发新能源,减少化石能源的使用 | |
| C. | 开发新型电池,推广废旧电池的回收、处理经验 | |
| D. | 用“绿色化学”工艺,使原料完全转化为目标产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠具有银白色的金属光泽,熔点高于100℃ | |
| B. | 钠具有强还原性,能与CuSO4溶液发生置换反应生成Cu | |
| C. | 将金属钠在空气中加热则生成白色固体 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有的化合反应不属于氧化还原反应 | |
| B. | 复分解反应部分属于氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | CO与CuO反应不是置换反应,但属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com